
faac chlated magnesium慢性腎臟病(Chronic kidney disease, CKD)在全球的盛行率約10%,病程主要特徵為腎絲球過濾率下降,其餘併發症則包含: 高血壓、貧血、高血鉀、代謝性酸中毒和腎性骨病變(chronic kidney disease—mineral and bone disorder, CKD–MBD)。其中,腎性骨病變是一種礦物質相關的骨骼疾病,特徵是高血磷、低血鈣、維生素D3含量減少、副甲狀腺素(parathyroid hormone, PTH)分泌增加,一旦進入繼發性副甲狀腺功能亢進症(secondary hyperparathyroidism, SHPT)的階段,將衍生出腎性骨營養不良和血管鈣化等臨床症狀。主要的治療方法為飲食限制磷,並使用磷酸鹽結合劑降低血清磷水平,治療目的是將磷、鈣和 PTH 調控於理想範圍,以減緩疾病進展。鎂是獨立於鈣之外的巨量元素,因此本篇的探討重點,是應用鎂做為降低腎性骨病變風險或新穎治療策略的可能性。
FGF23調控磷與副甲狀腺素
下圖來自2022年的期刊1,描述腎性骨病涉及腎臟、骨骼、副甲狀腺和腸道這四種系統,並透過FGF23、磷酸鹽、鈣、維生素D和PTH串連其影響。FGF23主要由骨骼細胞分泌,作用於腎臟中的 FGFR-Klotho複合體,促進腎臟排泄磷酸鹽,並反向調節維生素D3的合成。在腸道中,FGF23透過抑制鈉磷轉運蛋白活性,減少磷與維生素D3的吸收,誘導磷酸鹽負平衡。在副甲狀腺中,FGF-23可抑制PTH的合成與分泌,同時增加鈣敏感度受體(CaSR)和維生素D受體(VDR)的表達,對抑制PTH有協同作用。因此,在CKD患者中,會有較高濃度的 FGF23,用於減輕高磷血症,降低維生素D3含量,並抑制PTH的合成和分泌。
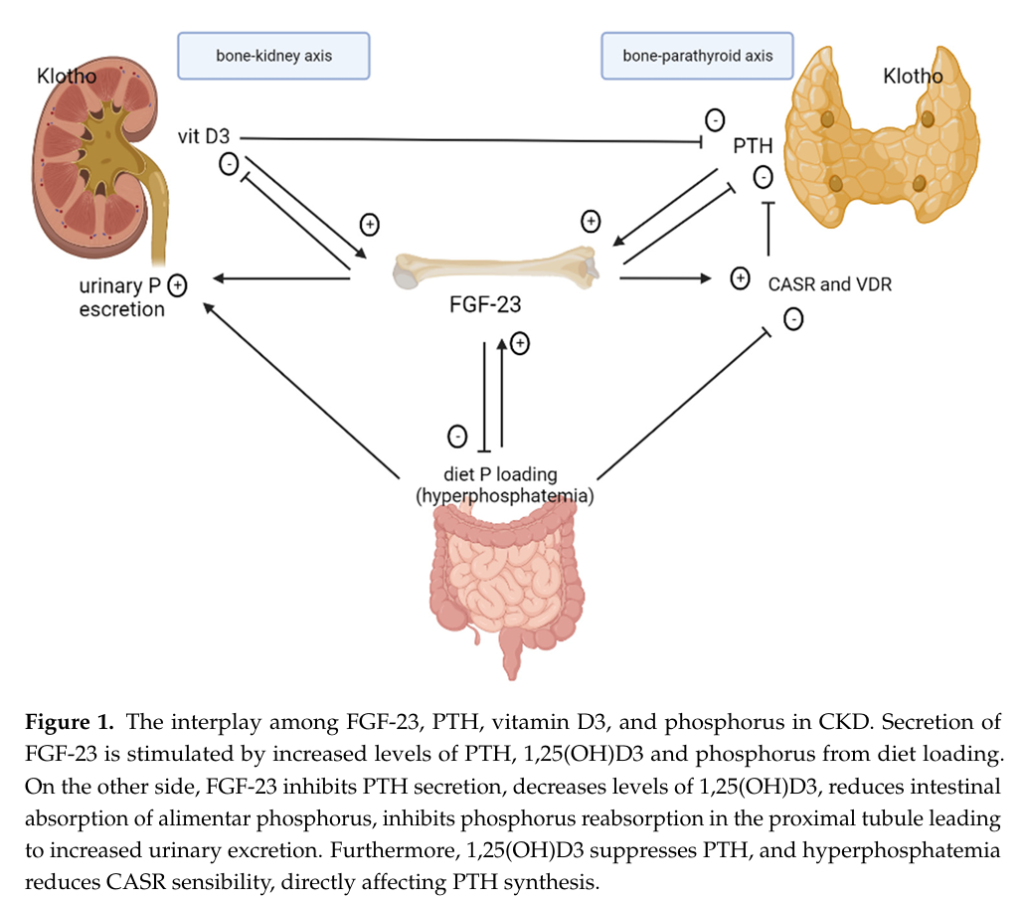
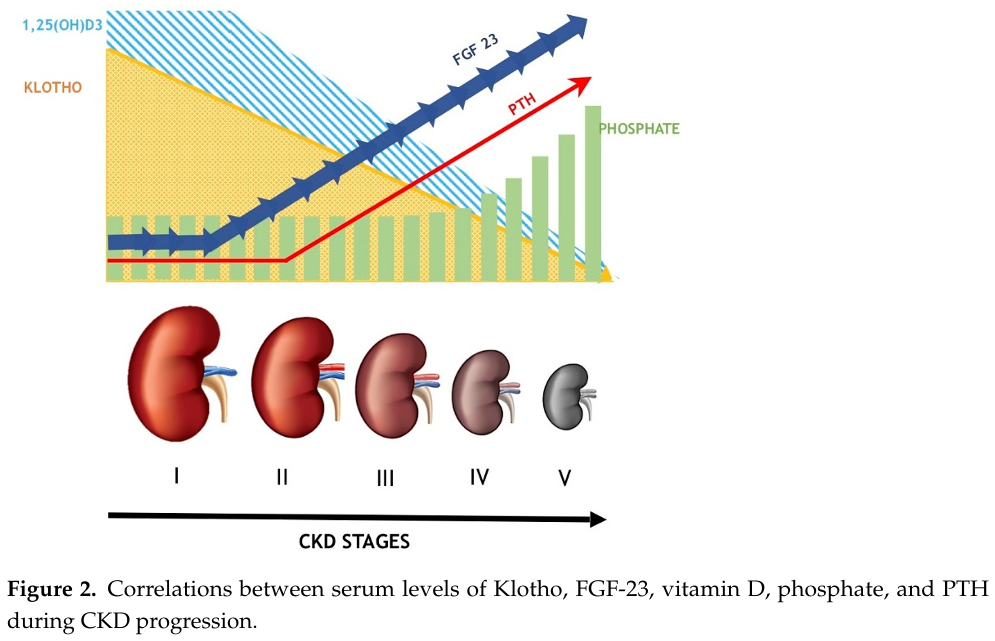
來自同論文的另一張圖,描述不同階段CKD患者的 FGF23、Klotho、磷酸鹽、PTH 和維生素D3含量之變化。從第一期到第五期,腎臟的功能逐漸惡化,除了腎絲球的過濾能力降低,也可透過生物標記進行監測。在CKD第一期,FGF23開始上升;到了CKD第二期,PTH開始上升。在晚期的CKD中,Klotho已減少到相當低,使得FGF因為找不到FGFR-Klotho複合物可供結合,因而丟失抑制PTH的功能。
副甲狀腺失調導致血鈣失衡
下圖來自2020年的期刊2,描述CKD的不同階段,腎絲球過濾率、血磷、血鈣的異常變化。腎絲球過濾率(GFR)由80毫升/分鐘,隨著病程惡化,降至低於20毫升/分鐘。在病程早期,GFR輕微衰退至70至79毫升/分鐘,副甲狀腺所分泌的PTH已經逐步上升。由於副甲狀腺的失調,CKD病人產生血磷、血鈣異常的比例,也隨之增加。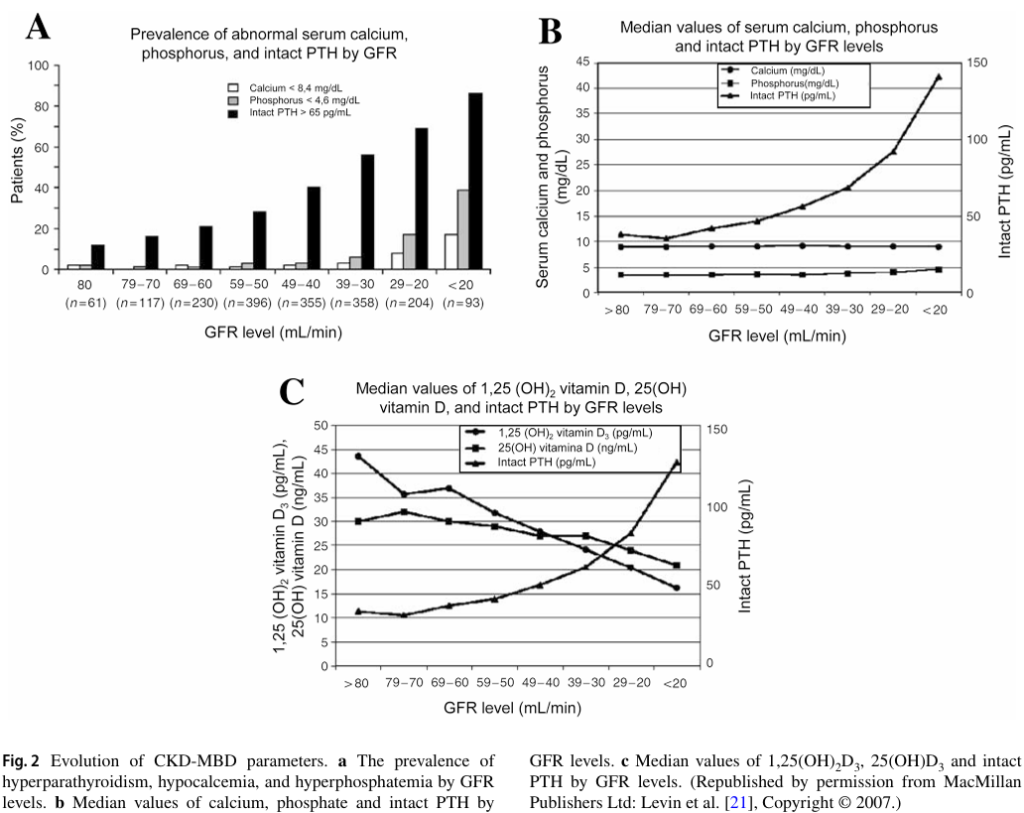
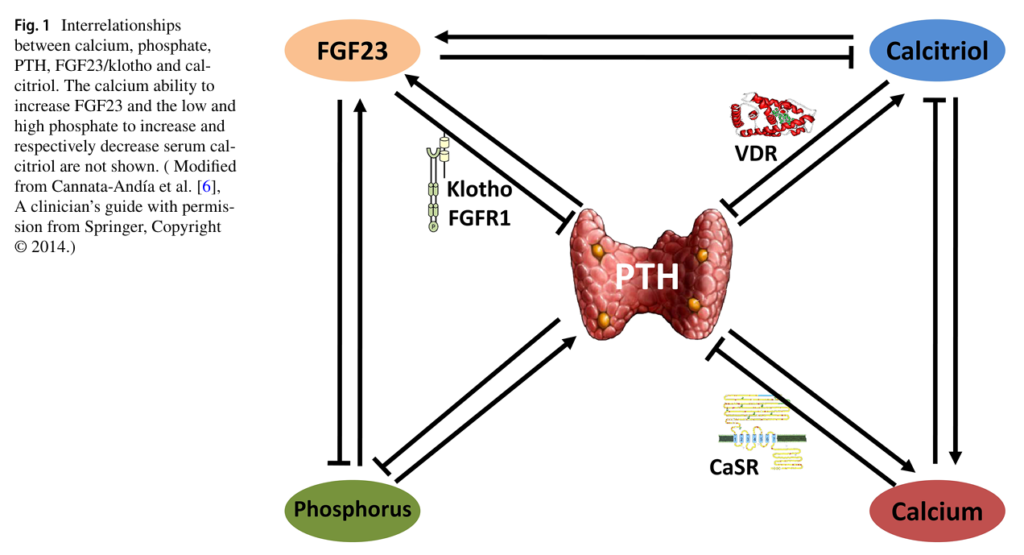
來自同論文的另一張圖,描述PTH透過維生素D受體(VDR)與鈣敏感度受體(CaSR),影響維生素D系統與鈣,導致骨骼和血管發生重要變化,例如:骨量減少、脆性骨折增加、血管和瓣膜鈣化增加。CaSR是一種G蛋白偶聯膜受體;VDR則是核受體,與維生素D結合後成為轉錄因子。 當CaSR 檢測到細胞外鈣濃度的短期下降,副甲狀腺將釋放儲存的 PTH;如果鈣減少持續較長時間,副甲狀腺則以轉錄、合成的方式增加PTH。
補充鎂改善腎性骨病變
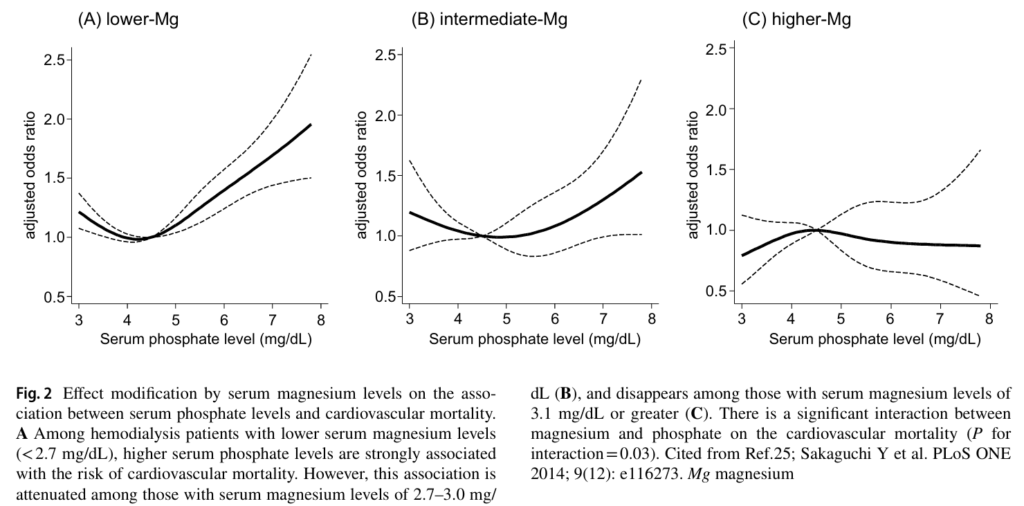
CKD患者中,低鎂血症並不罕見,盛行率約為 15%,暗示鎂缺乏極可能加速CKD病情的進展。鎂除了可以抵消磷酸鹽有害影響,似乎也能降低因血管鈣化所提升的死亡風險。下圖來自2022年的期刊3,研究納入142,555 名血液透析患者,比較透析前血清鎂濃度較低與一年內死亡的風險。結果顯示,患有輕度高鎂血症,即血清鎂水平2.7–3.0 mg/dL,顯示出最佳的存活率。上述證據顯示,適度補充鎂到輕度高血鎂的範圍,對於降低CKD病人是利大於弊,但在臨床上,需要更精心設計的監控,避免血清鎂提升過度,反而增加CKD病人的腎絲球負擔。
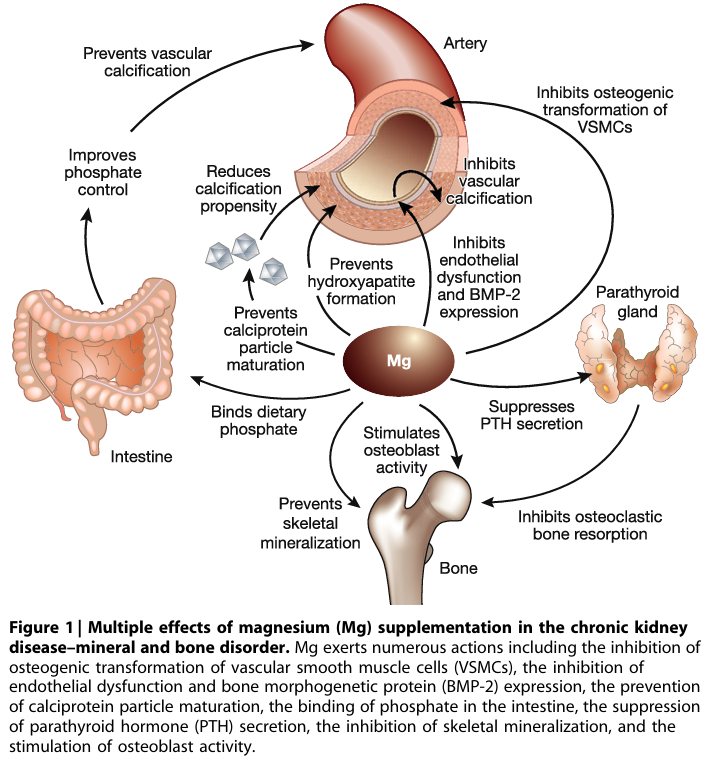
下圖來自2017年的期刊4,描述鎂對於腎性骨病變的保護,主要發生在四個部位: 在腸道,鎂可以結合飲食中的磷酸鹽,從源頭控制血磷;對於副甲狀腺,鎂可以抑制副甲狀腺素的分泌;對於血管,鎂可以抑制內皮功能障礙、預防鈣蛋白顆粒成熟;對於骨骼,鎂可以抑製成骨細胞、避免骨骼礦化。
總結:
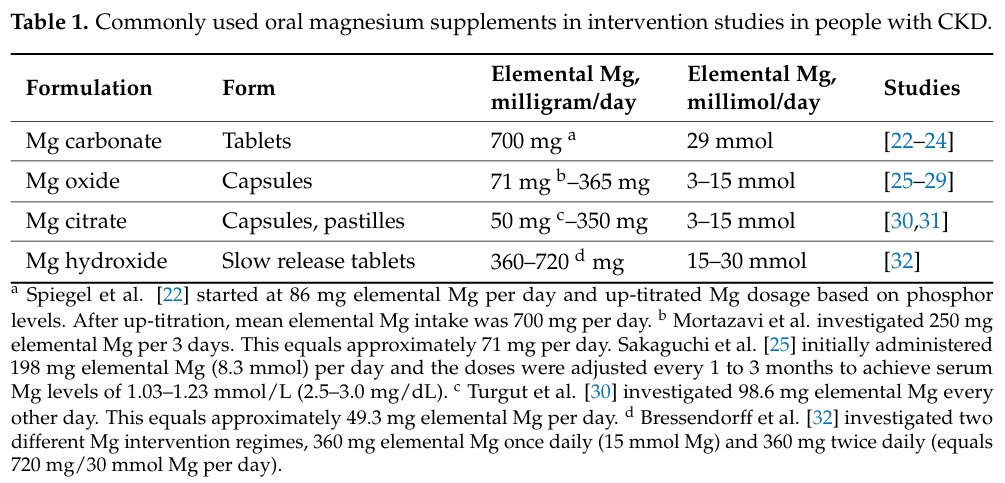
過去數年,鎂在CKD的臨床研究中,已證實血清鎂與CKD預後不良呈現負相關。鎂對於腎性骨病變有利的部分,在於干擾磷酸鹽的代謝,並預防血管鈣化;用於腎性骨病變需謹慎的部分,則是在造成骨骼過度缺磷缺鈣而脆化。鎂常用的給藥途徑,包含口服和點滴輸注,下表來自2023年的期刊5,列舉一些可供選擇的口服鎂製劑,由於元素鎂的每日劑量各不相同,其臨床適用性存在高度差異。因此,鎂用於治療腎性骨病變的決策重點,會是選擇合適的鎂補充劑,並設立臨床檢查點,確認補充鎂的最適當劑量,讓利益最大化的同時,最小化潛在的不良反應,避免患者發生骨折。
參考文獻:
Hu, L.; Napoletano, A.; Provenzano, M.; Garofalo, C.; Bini, C.; Comai, G.; La Manna, G. Mineral Bone Disorders in Kidney Disease Patients: The Ever-Current Topic. Int. J. Mol. Sci. 2022, 23, 12223. https:// doi.org/10.3390/ijms232012223
Jorge B. Cannata Andía, Beatriz Martín Carro, Julia Martín Vírgala, Javier Rodríguez Carrio, José Joaquín Bande Fernández, Cristina Alonso Montes, Natalia Carrillo López. Chronic Kidney Disease-Mineral and Bone Disorders: Pathogenesis and Management. Published online: 15 November 2020. Calcified Tissue International. https://doi.org/10.1007/s00223-020-00777-1
Yusuke Sakaguchi. The emerging role of magnesium in CKD. Clinical and Experimental Nephrology (2022) 26:379–384 https://doi.org/10.1007/s10157-022-02182-4
Naoto Hamano, Hirotaka Komaba, and Masafumi Fukagawa. Magnesium as a new player in CKD: too little is as bad as too much? Kidney International (2017) 92, 1034–1036; http://dx.doi.org/10.1016/j.kint.2017.05.032
Vermeulen, E.A.; Vervloet, M.G. Magnesium Administration in Chronic Kidney Disease. Nutrients 2023, 15, 547. https://doi.org/ 10.3390/nu15030547
