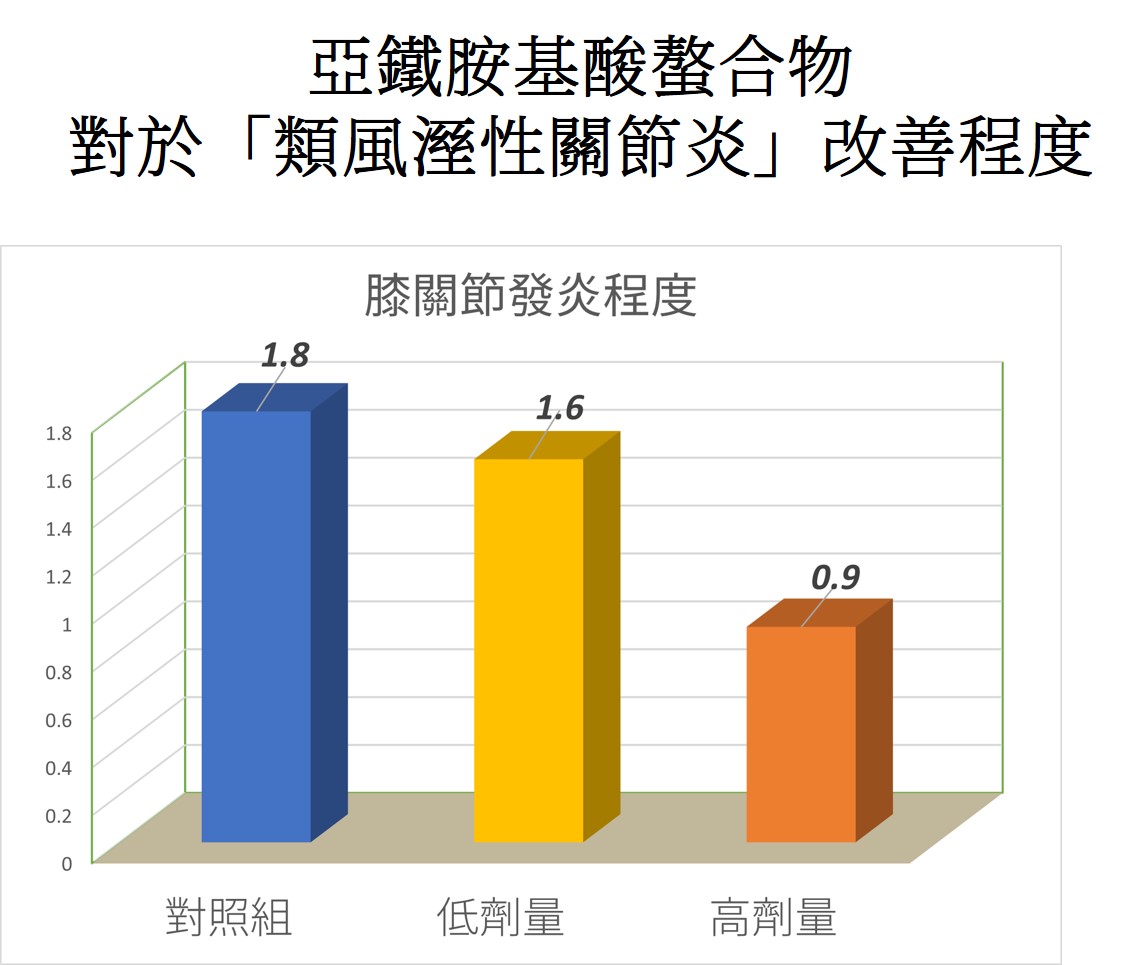
飛克在各方面的科學研究
鐵是許多細胞功能的重要組成部分,包括 DNA 複製和修復。作為一種必需元素,鐵對維持人體健康至關重要。 然而,過量的鐵可能導致DNA 的氧化損傷。許多研究觀察到鐵和癌症之間存在顯著關聯,而且這種關聯似乎不僅僅是巧合的。 癌症的主要特徵是過度增殖,這使它們比正常細胞更加依賴鐵,如何將癌細胞的此項差異用於癌症治療,已是被高度討論的新興策略。
鐵吸收與運送機制
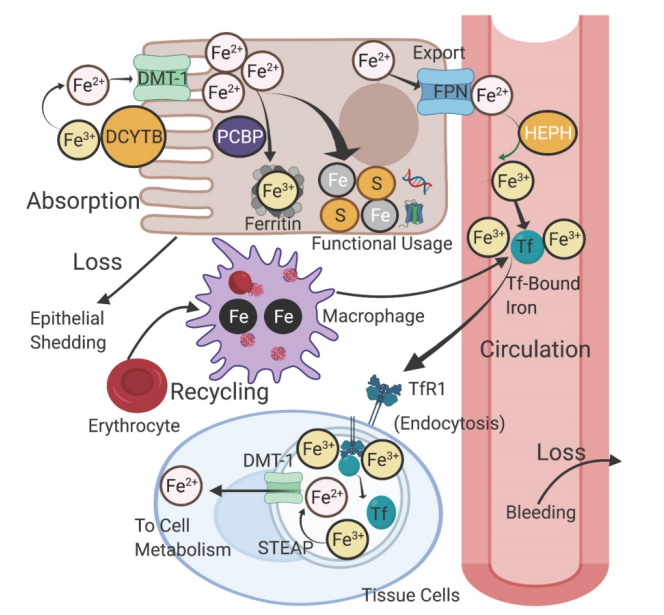
在探討癌細胞的鐵代謝前,先了解人體對於鐵的運用。下圖來自2021年的期刊論文1,描述了鐵在人體的吸收、運送。在腸道的位置,DcytB 將三價鐵還原為 二價鐵後,再由DMT-1 將二價鐵鐵吸收到腸細胞中;過多的鐵則轉為三價鐵,與Ferritin穩定結合。腸細胞到血管的部分,二價鐵可以通過 FPN 進入血管,隨後被 HEPH 重新氧化為三價鐵,與Tf穩定結合後,在血管中循環。在周邊組織,大部分的循環鐵,都是通過TfR1受體介導的內吞作用,輸送到其中。 Tf和三價鐵在細胞中解離,之後三價鐵被 STEAP 蛋白還原為二價鐵並進入胞質溶膠,用於細胞代謝使用。循環鐵主要來源是衰老紅血球細胞,這是一個由巨噬細胞介導的回收過程。
鐵平衡的調控機制
下圖來自2021年的期刊論文1,描述了鐵在人體的平衡,主要調控機制包含Hepcidin、HIF 和 IRP/IRE 系統。在腸道到血管的位置,Hepcidin是FPN這個通道的抑制開關,血鐵過高時,Hepcidin抑制FPN;貧血時,抑制Hepcidin,導致FPN打開。在周邊組織,HIFs 對低氧和鐵水平做出反應並轉錄基因,以幫助細胞適應感知到的環境缺陷,做出的短期和長期的變化,包括血管生成、鐵供應和周邊細胞的新陳代謝。在細胞中,IRP 與IREs結合,在5′ UTR 與3′ UTR控制不同種類鐵代謝相關蛋白的轉錄。
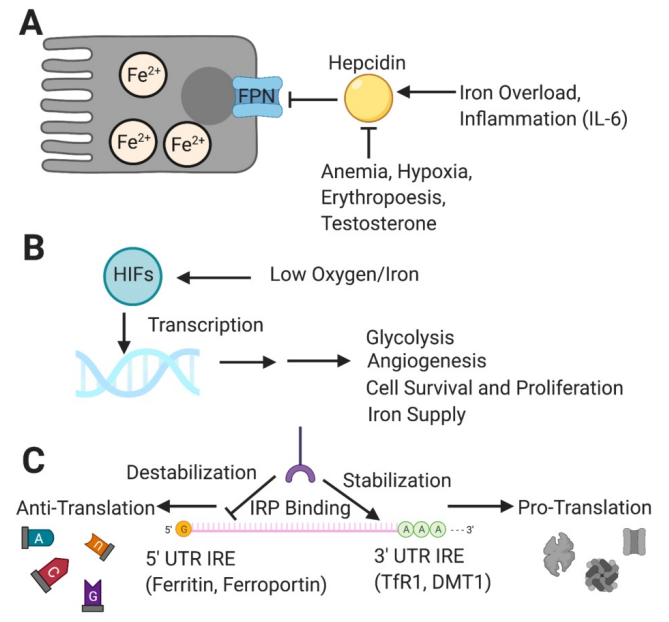
瞄準癌細胞鐵代謝異常的治療策略
下圖同樣來自2021年的期刊論文1,描述鐵代謝異常對於癌細胞的影響。癌細胞跟人類正常細胞一樣,其生存也是需要鐵的平衡與穩定。癌細胞內的鐵不足,會限制其細胞增值,例如使用TfR1 介導之鐵螯合劑或抑制TfR1、HIF,均可降低細胞中鐵的可用量;若為抑制 hepcidin-FPN 軸,則可增鐵輸出,從而剝奪癌細胞中的鐵。從另一個大方向看,讓鐵的影響過量,也是另一種影響癌細胞存活的策略,像是抑制細胞抗氧化防禦系統GPX4,癌細胞容易從鐵代謝中積累 ROS,最終導致脂質過氧化和鐵凋亡。

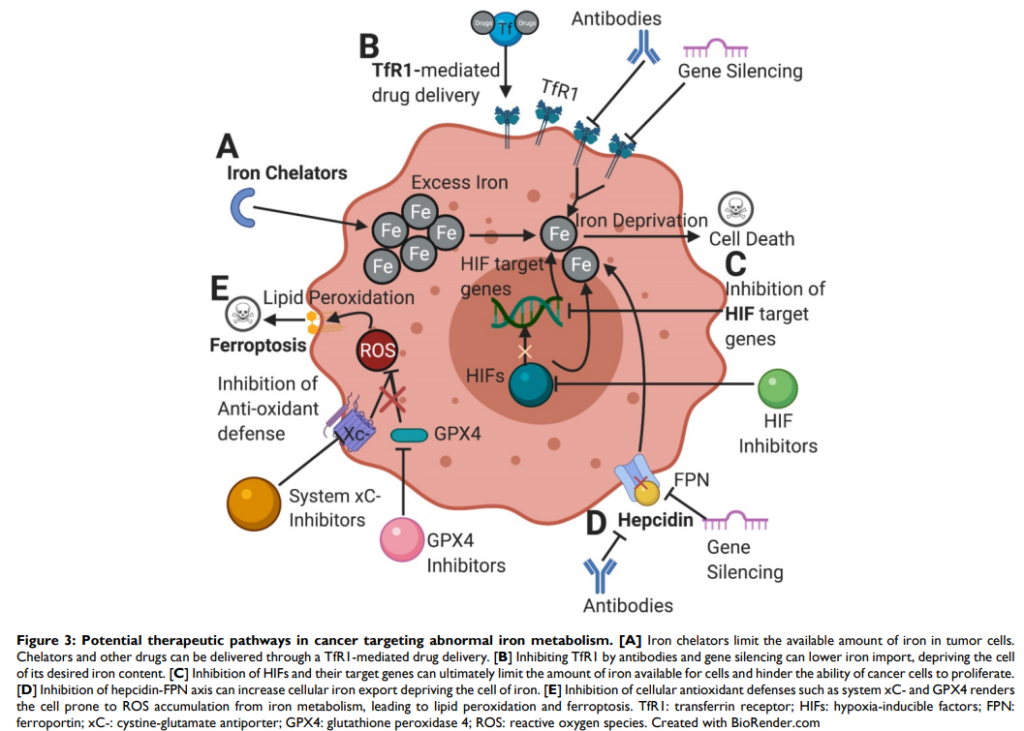
誘發癌細胞鐵凋亡的癌症治療靶點
下圖來自2021年的頂尖期刊Nature 2,揭露可用於癌症治療的鐵凋亡靶點,除了過去習知的 GPX4 (穀胱甘肽過氧化物酶)、FSP1 (鐵死亡抑制蛋白1),還新增了一項DHODH。作者設計實驗證明,加入DHODH 抑製劑brequinar,讓DHODH 的失活會導致GPX4低表達癌細胞中的線粒體脂質過氧化和鐵死亡;若在GPX4高表達的癌細胞中,與FDA 批准的鐵死亡誘導劑 Sulfasalazine 合併使用,可產生協同作用。這些結果確定了線粒體中 DHODH 介導的鐵死亡防禦機制,有潛力成為癌症治療中靶向鐵死亡的治療策略。
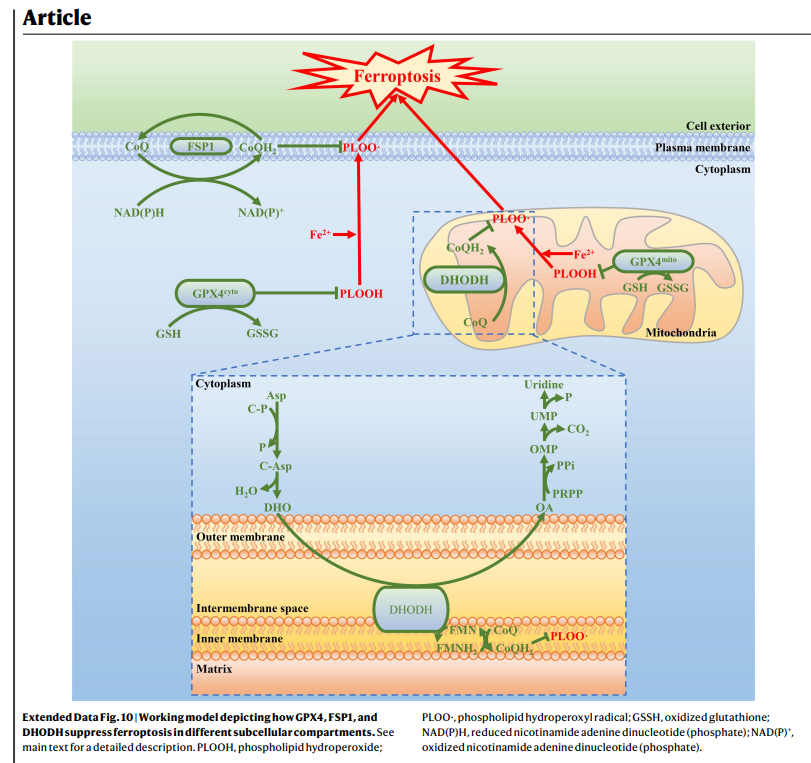
鐵代謝異常癌症的臨床表徵與治療策略
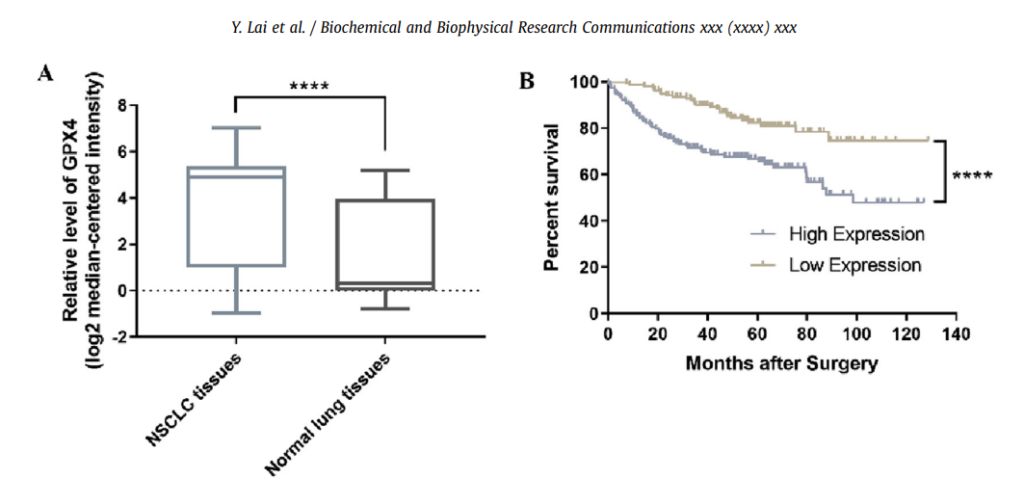
下圖來自2019年的期刊論文3,分析了NSCLC (小細胞肺癌)、GPX4表達量與病人存活率之間的關聯性。基於 ONCOMINE 數據庫、臨床標本和細胞操作的結果顯示, GPX4 在 NSCLC 組織中上調,並且預測 GPX4 高表達使得預後較差。正因為鐵死亡是小細胞肺癌中受到抑制的抗腫瘤因子,使得靶向鐵死亡,有機會成為此一類型肺癌的治療策略。
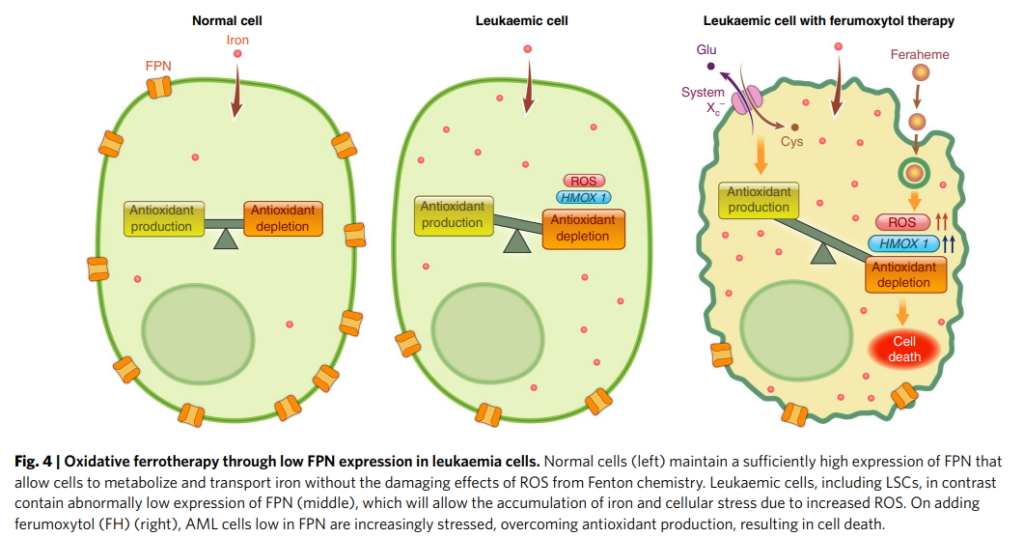
下圖來自2019年的期刊論文4,描述用過量的鐵來治療血癌的新策略。血癌細胞特色為低表達FPN,也是屬於鐵代謝異常的癌症,因此作者利用FAD核准用於治療貧血的奈米氧化鐵藥物Ferumoxyltol,採針劑注射,誘發血癌細胞鐵凋亡。在這個概念中明確的指出,不一定要用標靶藥物誘發癌細胞鐵凋亡,用過量的鐵,也能誘發鐵凋亡來治療鐵代謝異常的癌症。
總結:
鐵的吸收、運送,在人體中均被嚴密的調控,一旦鐵含量過高,就會啟動調節機制,避免過多的鐵造成氧化損傷;但某些癌細胞的特性,卻是鐵代謝異常,允許大量的鐵進出,又不至於過載。癌症治療如使用化療,腸道黏膜的通透性會增加,在此狀態下,不使用針劑注射,也能讓螯合鐵進入血管內的量上調,產生能讓鐵代謝異常癌細胞鐵過載、鐵凋亡的契機。如何定義出治療劑量與安全劑量,將穩定、好吸收的螯合鐵,應用於治療鐵代謝異常癌症,值得科學家進一步臨床實證。
參考文獻:
1. Michael Morales, Xiang Xue. Targeting iron metabolism in cancer therapy. Theranostics 2021, Vol. 11, Issue 17.
2. Chao Mao, Xiaoguang Liu, Yilei Zhang, Guang Lei, Yuelong Yan, Hyemin Lee, Pranavi Koppula, Shiqi Wu, Li Zhuang, Bingliang Fang, Masha V. Poyurovsky, Kellen Olszewski & Boyi Gan. DHODH-mediated ferroptosis defence is a targetable vulnerability in cancer. Nature | Vol 593 | 27 May 2021.
3. Yuanyang Lai, Zhipei Zhang, Jianzhong Li, Weimiao Li, Zhao Huang, Chenxi Zhang, Xiaofei Li, Jinbo Zhao. STYK1/NOK correlates with ferroptosis in non-small cell lung carcinoma. Biochemical and Biophysical Research Communications. Biochem Biophys Res Commun. 2019 Nov 19;519(4):659-666.
4. Vicenta Trujillo-Alonso, Edwin C. Pratt, Hongliang Zong, Andres Lara-Martinez, Charalambos Kaittanis, Mohamed O. Rabie, Valerie Longo, Michael W. Becker, Gail J. Roboz, Jan Grimm and Monica L. Guzman. FDA-approved ferumoxytol displays antileukaemia efficacy against cells with low ferroportin levels. Nat Nanotechnol. 2019 Jun;14(6):616-622.






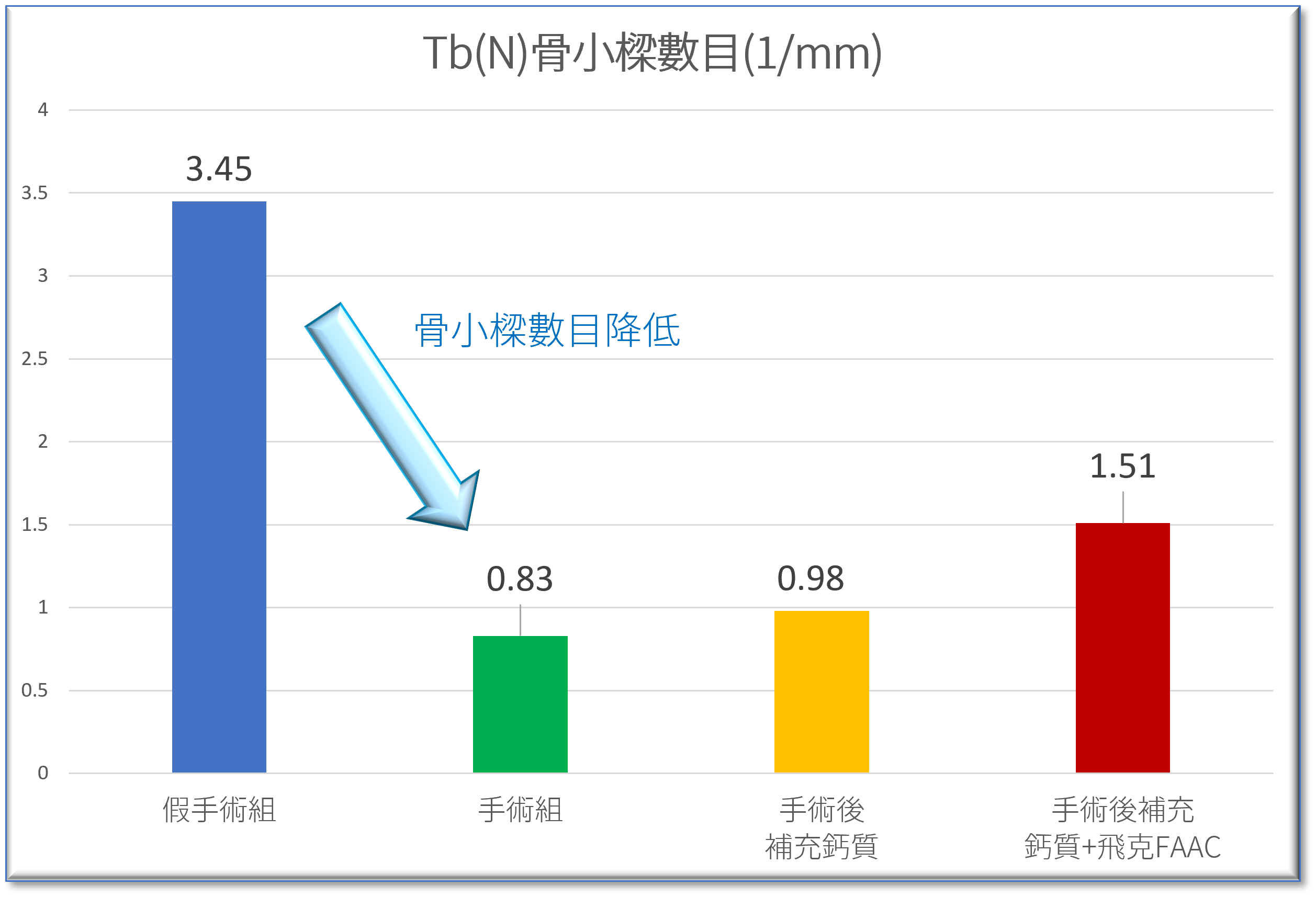
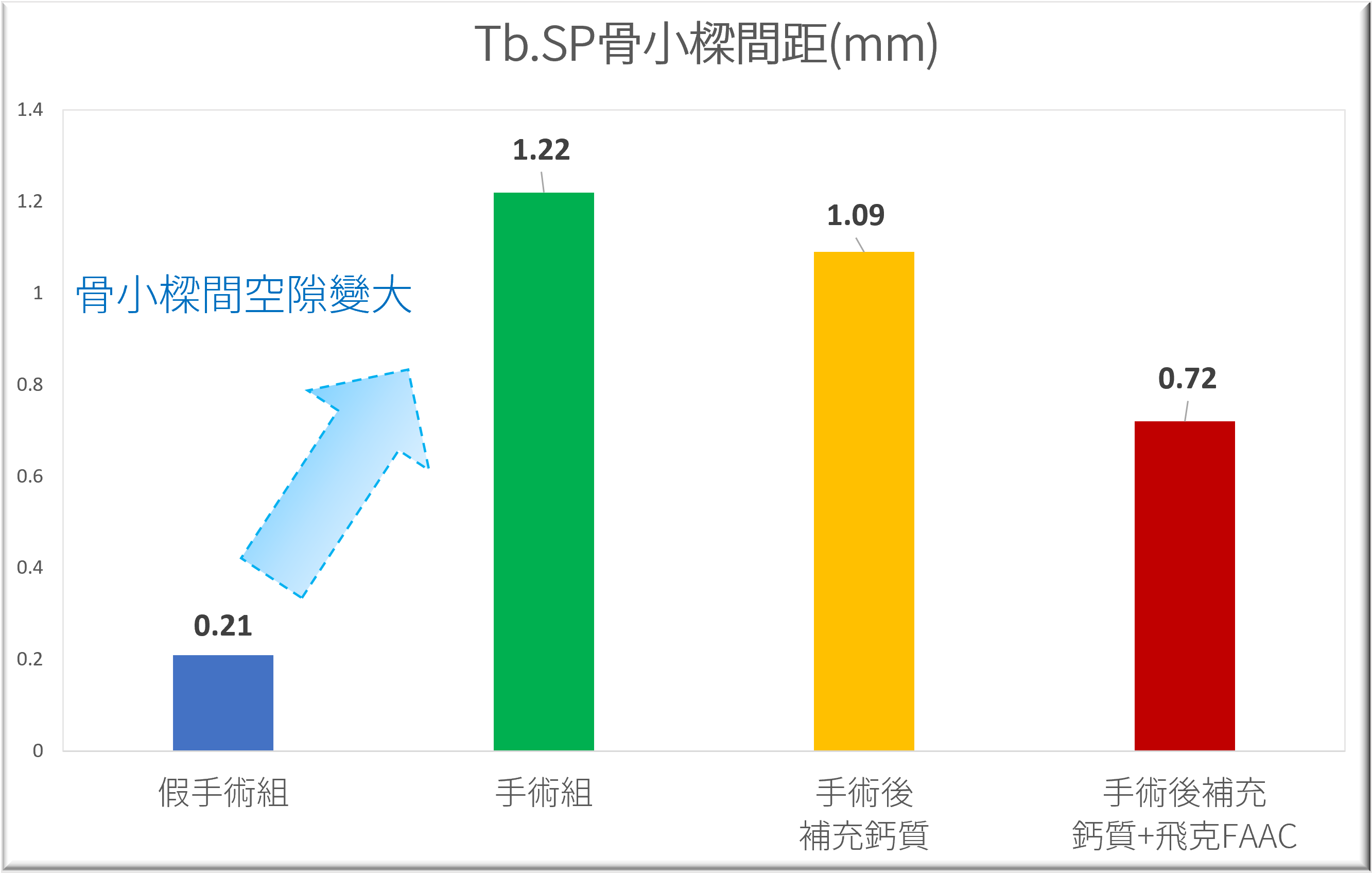
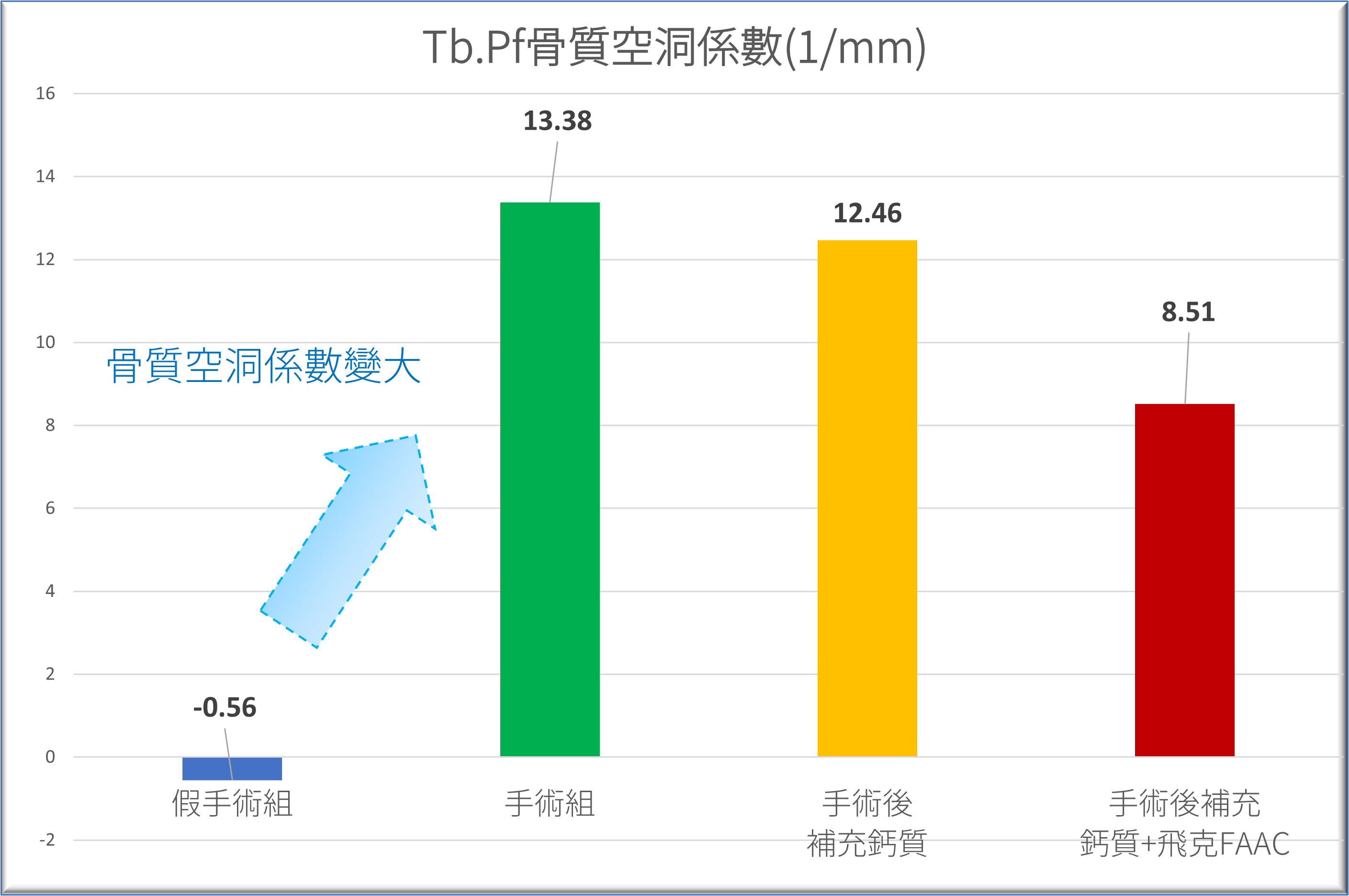
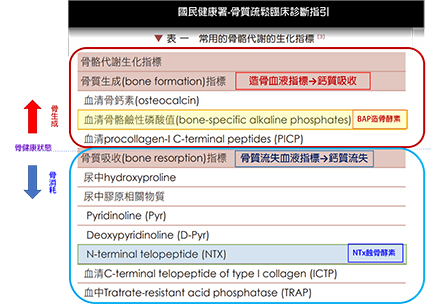
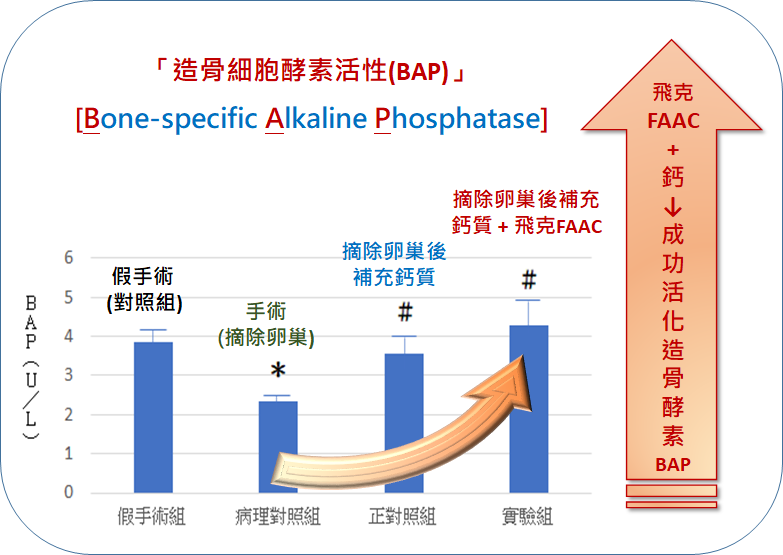
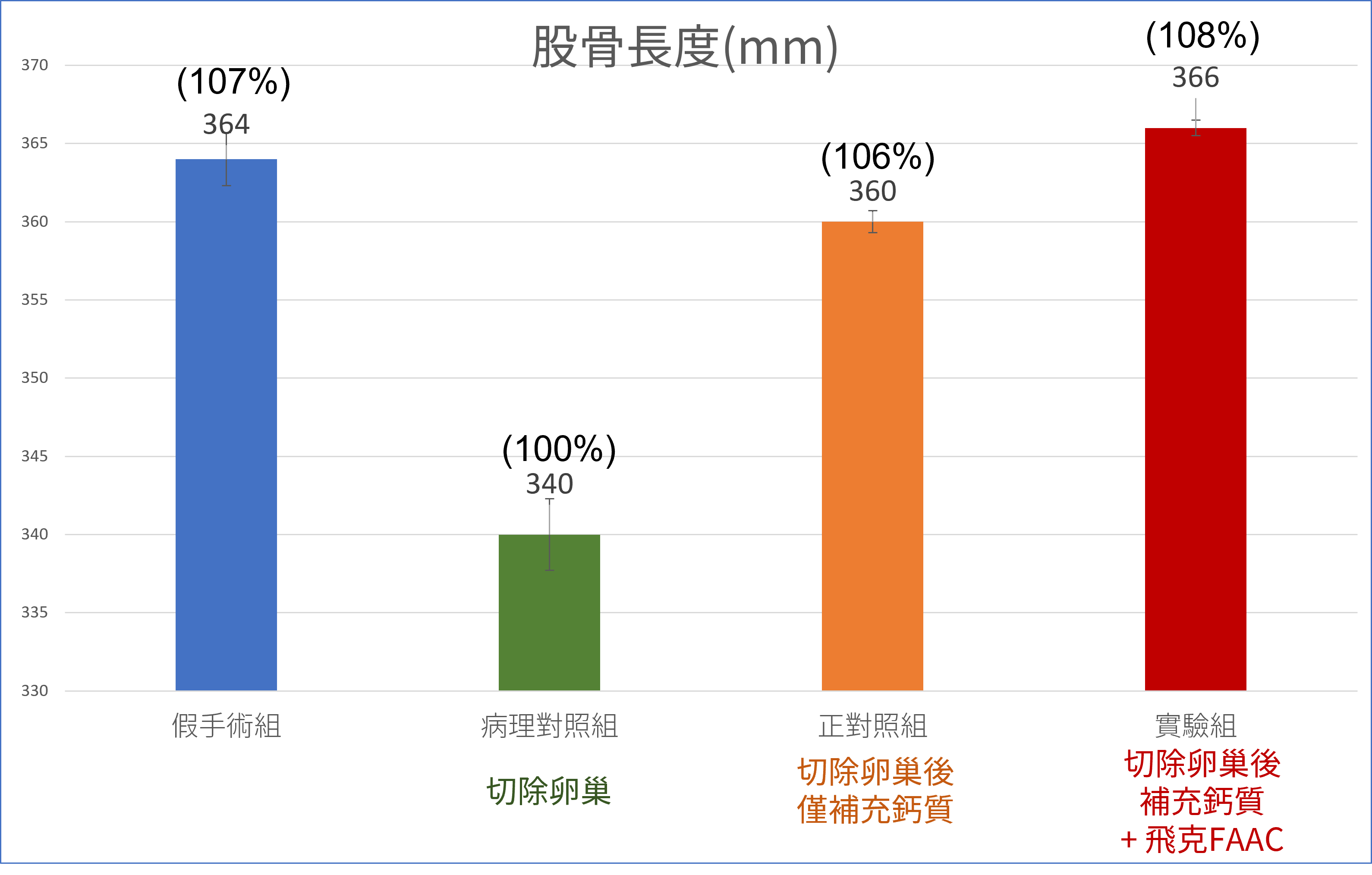
的血液指標-NTx-蝕骨活性蛋白測定-1.png)









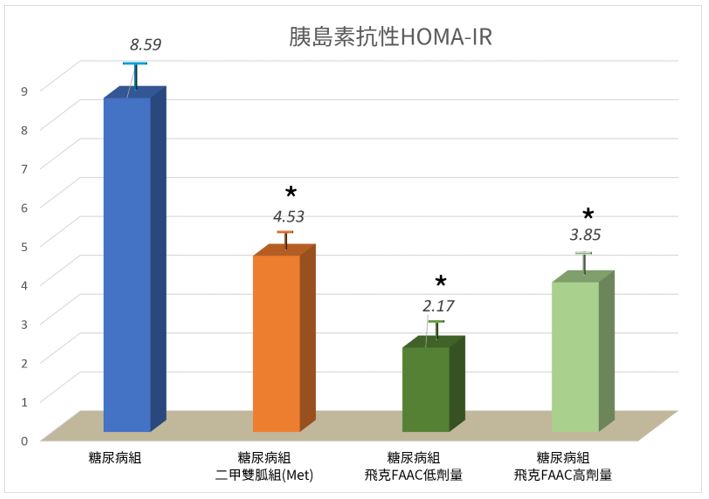
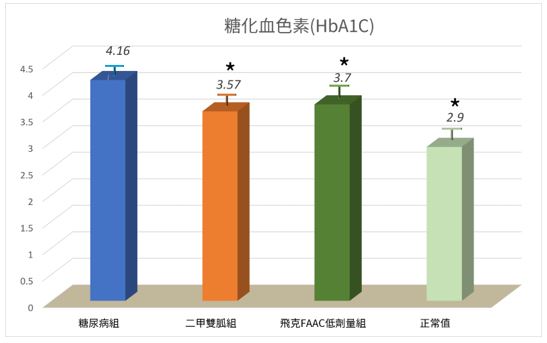

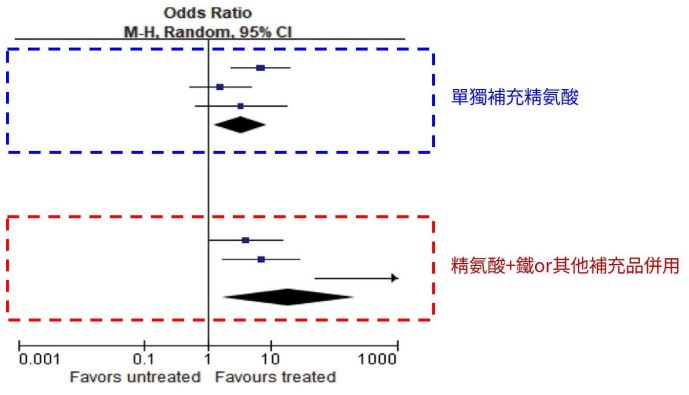
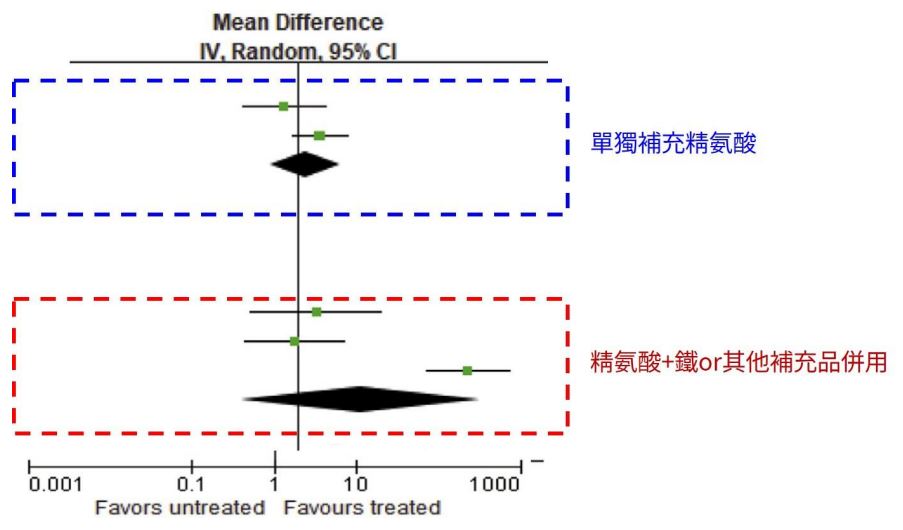
 「精胺酸+聯合補充劑」對勃起功能障礙(ED)的有效應用:系統性臨床評估彙集與整合分析
「精胺酸+聯合補充劑」對勃起功能障礙(ED)的有效應用:系統性臨床評估彙集與整合分析