癌細胞增大過程中,會分泌更多乳酸。這些乳酸會刺激癌細胞周圍的「間質細胞」,使其表現出更多生長因子,增強癌細胞抵擋標靶藥物毒殺的能力,這使癌細胞對標靶藥物產生「抗藥性」
義大利Candiolo癌症研究院(Candiolo Cancer Institute)研究團隊發現,癌細胞長期培養於含抗癌「標靶藥物」的培養液中,會產生更多乳酸。這些乳酸會刺激癌細胞周圍的「間質細胞」,使其表現出更多生長因子,增強癌細胞抵擋標靶藥物毒殺的能力,這使癌細胞對標靶藥物產生「抗藥性」。他們也在動物實驗證明,以藥物抑制癌細胞分泌乳酸,可削減癌細胞的抗藥性。研究已於 2018年8 月刊登於指標性科學期刊《細胞新陳代謝》(Cell Metabolism)。
癌細胞對標靶藥物的「抗藥性」(Drug resistance)
有部分癌症病患已有相對應的標靶藥物可治療,且治療初期都能有效控制住病情,副作用也較小。但無可避免地,腫瘤或快或慢大多數都會產生抗藥性而導致癌症復發。有些幸運的病患能接受下一代標靶藥物治療繼續控制病情,但其他病患只能回到使用傳統化療藥物。
早期研究癌細胞如何產生抗藥性的結果顯示,當標靶藥物將具有目標突變蛋白的癌細胞消滅時,那些也存在於腫瘤中、但不帶有此突變的癌細胞可趁機竄起。換句話說,標靶藥物造成的「生存壓力」加速癌細胞「演化」,篩選出具抗藥性的癌細胞。
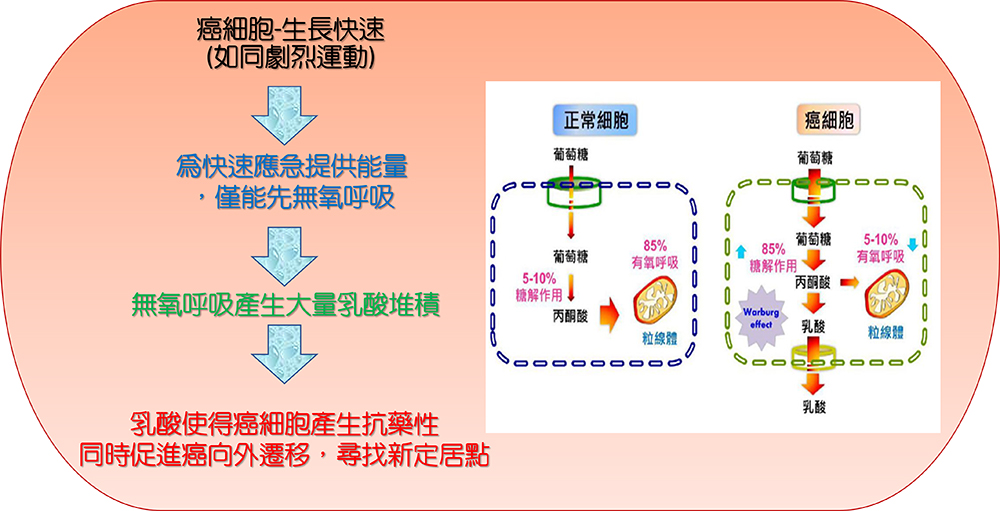
快速生長的癌細胞產生大量乳酸,讓癌細胞對抗癌藥產生抗藥性、同時促發癌細胞轉移
圖1.快速生長的癌細胞產生大量乳酸,讓癌細胞對抗癌藥產生抗藥性、同時促發癌細胞轉移
「細胞非自主性抗藥性」(Non-cell autonomous drug resistance)
Simona Corso 博士本次研究最初時,對長了腫瘤的小鼠持續注射標靶藥物(JNJ-605),起初腫瘤會縮小,但一段時間後抗藥性產生了,腫瘤又再度復發。有趣的是,當他們分離出腫瘤內的癌細胞後,卻發現這些細胞大多數仍然會被標靶藥物毒殺,再將這些癌細胞接種到小鼠體內後,它們又會形成具抗藥性的腫瘤;再次分離這些抗藥腫瘤的癌細胞,卻又被標靶藥物毒殺了。面對這樣看似不合理的結果,您可能會懷疑是否研究人員的實驗過程出了差錯,甚至應該放棄研究方向,但 Simona Corso 博士則基於上述的實驗結果,抽絲剝繭慢慢理出頭緒。
其實近年來已有一些研究發現,除了癌細胞「本身」變化以外,它們與周圍的間質細胞(stromal cell)的互動也對癌細胞的抗藥性有影響力。當這些間質細胞分泌更多生長因子,活化癌細胞內的訊息傳遞時,有可能提供癌細胞抵抗標靶藥物的能力。然而究竟是什麼因素促使間質細胞生產更多生長因子?之前的科學家並不清楚。
Corso 博士決定將注意力轉向腫瘤內的間質細胞。當他們分離出抗藥腫瘤內的間質細胞(腫瘤相關纖維母細胞,cancer-associated fibroblast 簡稱 CAF),並與癌細胞一起培養時,有了令人振奮的發現!此時癌細胞的抗藥性大大提高,證明了腫瘤的抗藥性是來自這些間質細胞的變化。他們也發現這些間質細胞分泌的大量生長因子 HGF,就是幫助癌細胞對抗標靶藥物的關鍵。
癌細胞本身有何變化
雖然抗藥性腫瘤分離出的癌細胞本身不具抗藥性,但研究團隊注意到它們的新陳代謝已發生明顯變化。這些癌細胞一些與葡萄糖代謝相關的基因(HK2、Glut1、MCT4 等)表現量都增高了,且消耗葡萄糖的速率比原本不具抗藥性的癌細胞高出一倍,分泌的乳酸也多出一倍。當他們測試乳酸如何影響 CAF 時發現,它會使 CAF 表現更多生長因子 HGF。這些發現勾勒出,為什麼癌細胞單獨時無法呈現抗藥性,只有與 CAF 共同培養時才有抗藥性。
新發現的抗癌契機
上述發現直指乳酸是促成這些癌細胞演化出抗藥性的關鍵,因此研究團隊測試了多種抑制乳酸作用的藥物對腫瘤產生抗藥性的影響。以小鼠進行的實驗結果顯示,無論使用抑制癌細胞產生乳酸的藥物(NHI-Glc-2)或抑制 CAF 吸收乳酸的藥物(AZD3965),都能有效阻絕腫瘤出現對標靶藥物的抗藥性!
已有許多研究證據指出,腫瘤內的乳酸是促進癌症惡化的關鍵之一,乳酸能增進癌細胞轉移能力及產生對化療藥物的抗藥性等。本次研究則發現標靶藥物,會使小鼠身上的癌細胞新陳代謝發生變化,分泌更多乳酸而產生抗藥性。這些發現顯示,運用抑制腫瘤乳酸新陳代謝的藥物來輔助標靶藥物治療癌症,有可能減少抗藥性產生,非常值得以臨床試驗評估可行性。
參考資料:
1. Increased Lactate Secretion by Cancer Cells Sustains Non-cell-autonomous Adaptive Resistance to MET and EGFR Targeted Therapies (doi: 10.1016/j.cmet.2018.08.006.)
Cell Metab. 2018 Dec 4;28(6):848-865.e6. Epub 2018 Aug 30.

