鉑金類是最常用化療藥物,佔臨床使用的所有抗癌藥物的幾乎 50%。鉑金類藥物(如順鉑)的治療效果扮演著關鍵的作用。在癌細胞中,順鉑將NADPH 轉化為NAPD+的氧化反應「NOX」(NAPDH Oxidase),放出一個電子,作為連鎖反應的起始物質,在粒線體中形成 H2O2 及其下游的超氧自由基(ROS)來破壞雙股DNA的複製合成。
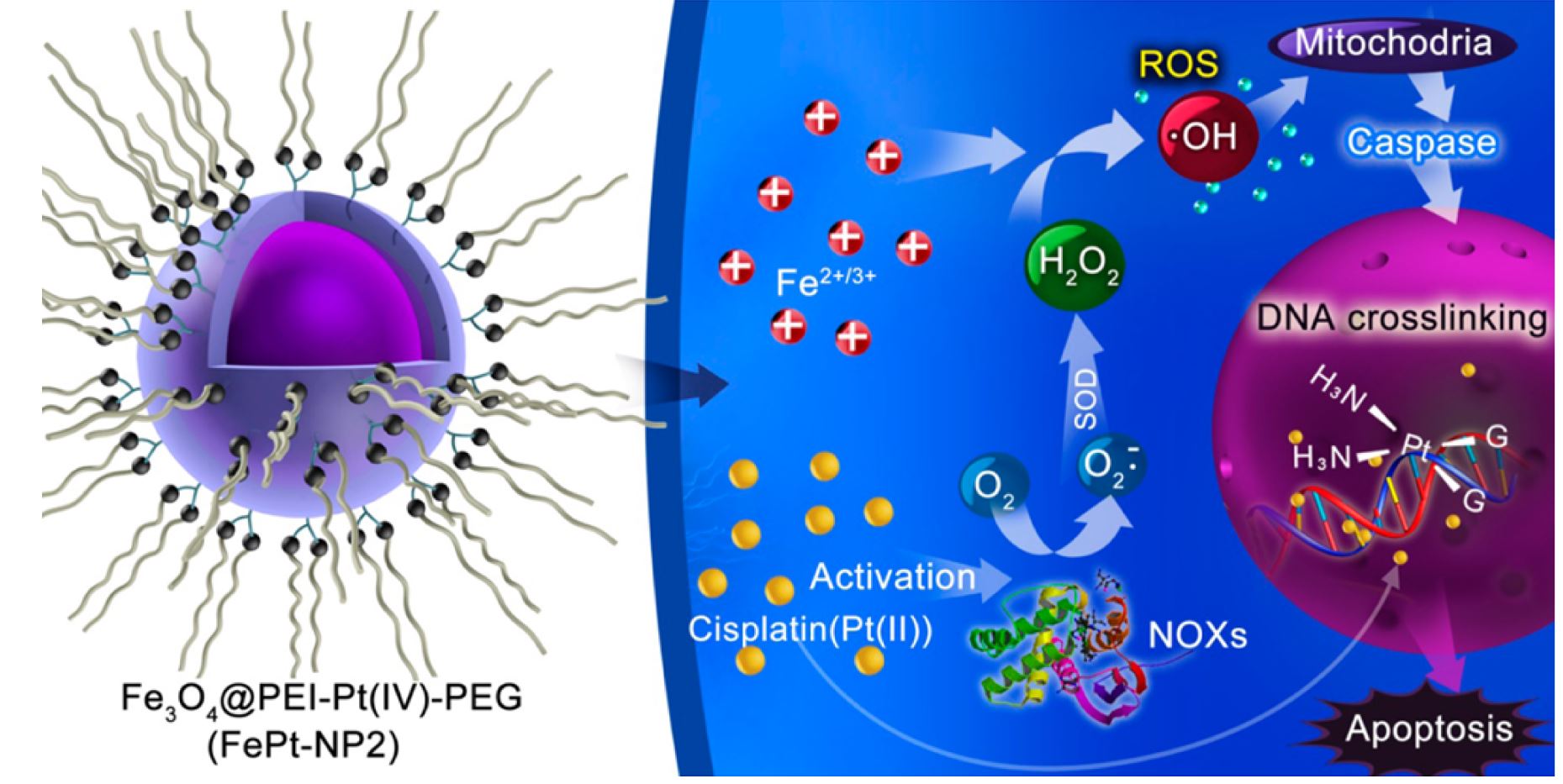
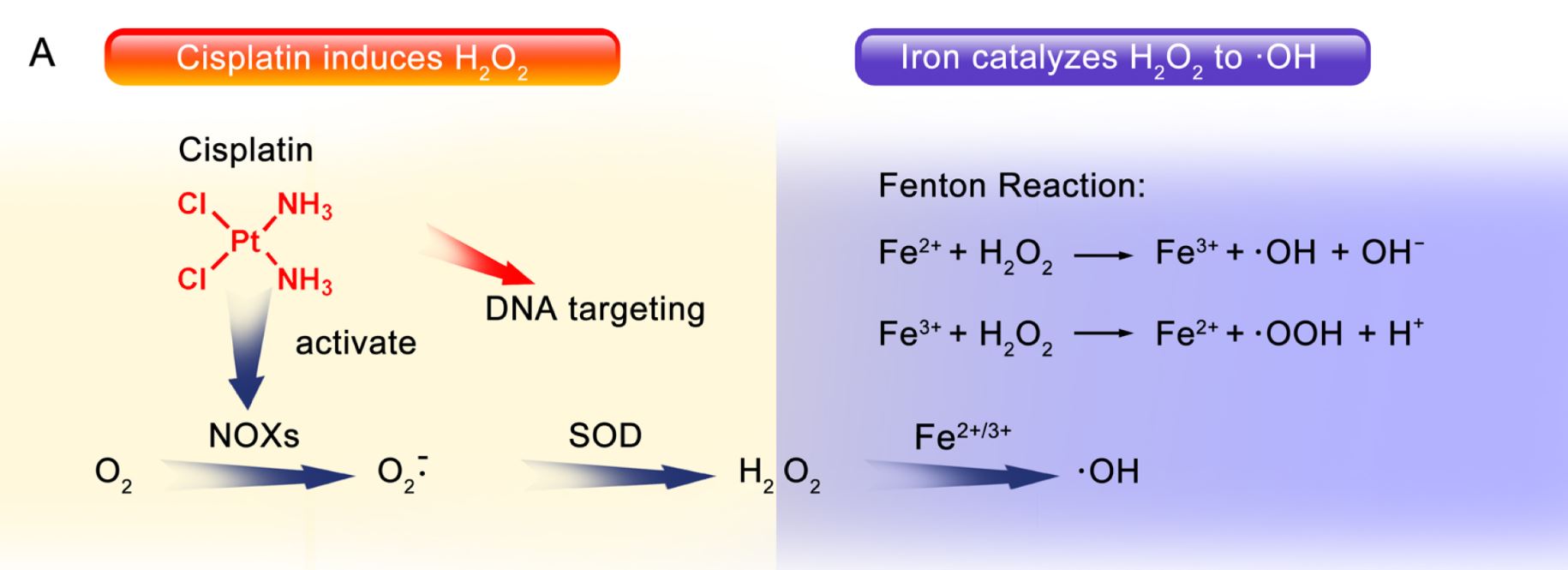
圖2.鉑金類藥物(左)與亞鐵離子(右)皆可引發芬頓反應(Fenton Reaction),產生毒殺癌細胞的超氧自由基(.OH)
本研究揭示了一種藥物傳遞系統策略,利用從氧化鐵奈米載體來讓癌細胞對於提高對於鉑金類藥物的敏感度,以增強抗癌功效。通過含氧化鐵的微脂體將鉑金類藥物包覆其中,讓細胞透過自然吞噬的方式將藥物送到細胞中,才將藥物釋出,這樣的藥物釋放方式大幅度地避免了誤殺到其他正常細胞的機率,也降低了原本鉑金類藥物所伴隨的巨大副作用,不僅提高了治療的效率,且更增加預後復原的成功率和存活率。
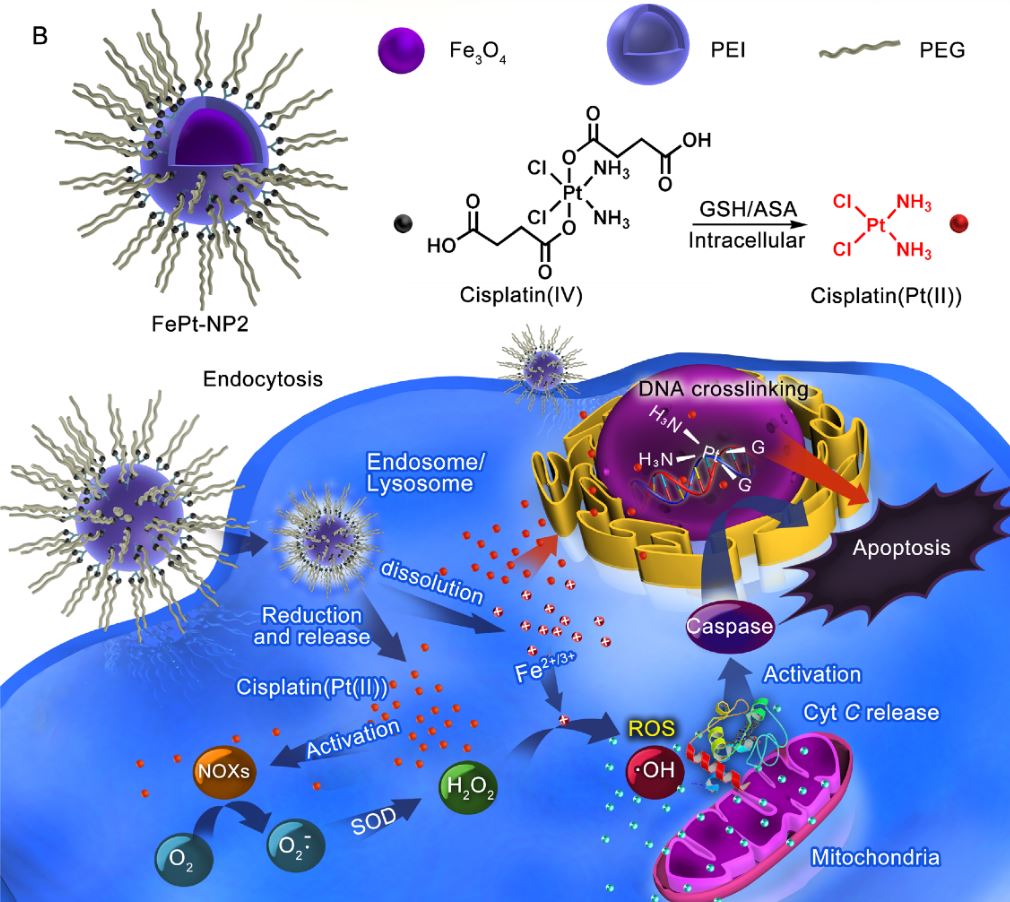
圖3.以奈米鐵包覆鉑金類藥物的藥物傳遞系統,以吞噬方式進入細胞後才釋出藥物,減低藥物毒性
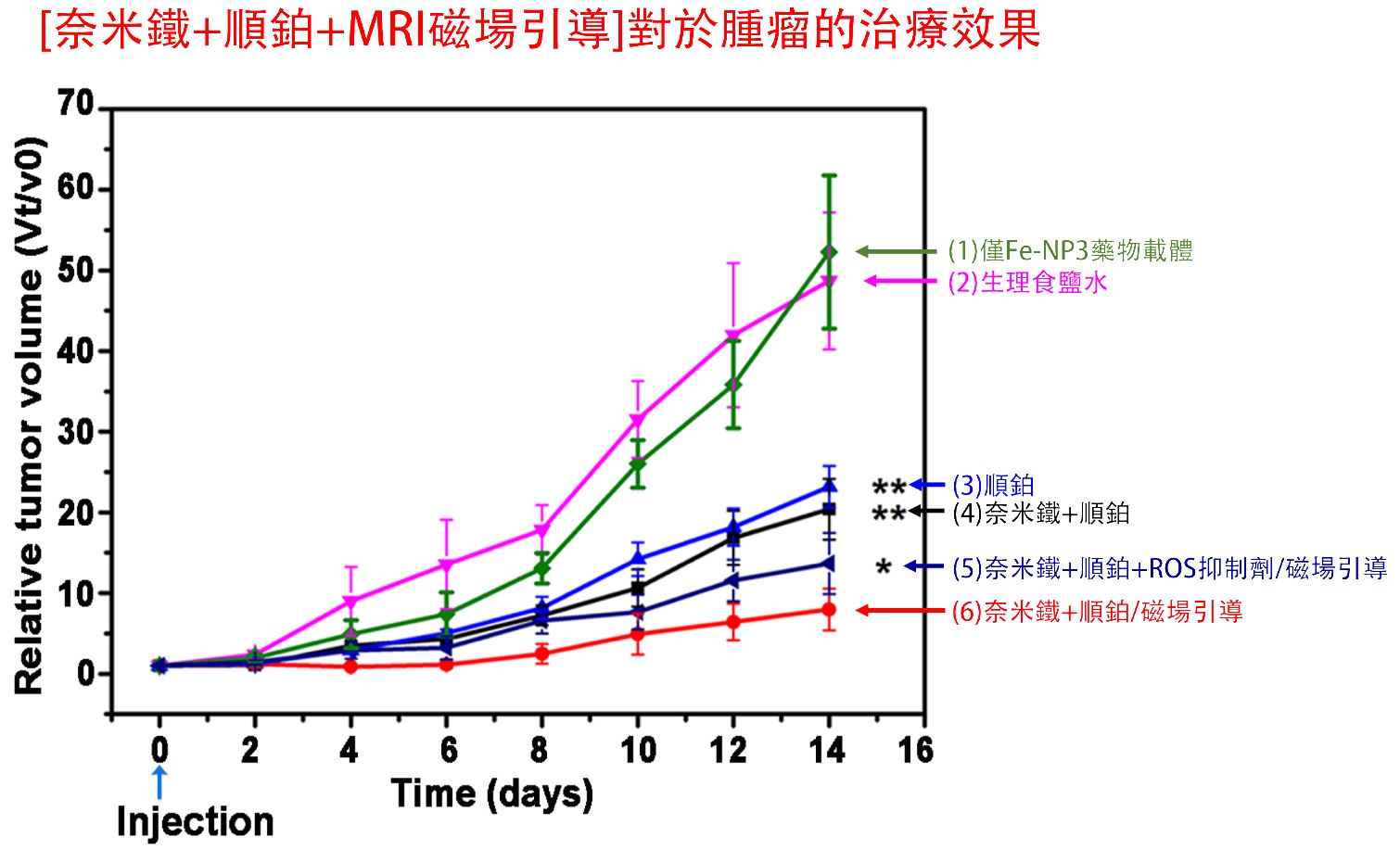
圖4.[奈米鐵載體+順鉑化療藥+MRI磁場精準定位引導] 對於腫瘤的治療效果
由上述試驗可知:
1.空白 Fe-NP3奈米鐵載體 的體內評估顯示未發現顯著毒性,在第14天,將小鼠僅單純使用(3)順鉑治療的組別相較於[(6)奈米鐵載體+順鉑化療藥+MRI磁場精準定位引導]的組別,使用組別(6)腫瘤抑制效果相差約23倍。
2.ROS抑制劑在一定程度上抵消了(6)完整藥物的生長抑製作用,最終腫瘤生長約15倍。這些結果證明了 ROS 參與了這個過程。
3.而空白的(1)藥物載體和(2)生理食鹽水組顯示腫瘤快速增長,達到相對腫瘤體積約 50 倍。
4.在附加磁場的情況下,腫瘤生長在第 14 天被大大抑製到只有相對腫瘤體積的 5 倍左右。整體第(6)組的優勢主要是增加 超氧自由基ROS 的產生,這對於降低腫瘤細胞的抗藥性非常重要。
在本研究的結果中發現,通過使用[氧化鐵奈米載體+順鉑+MRI精準磁場導引]形式遞送 ROS 誘導抗癌藥物順鉑,該載體可以通過磁場優先增加腫瘤部位的鉑金 和鐵分子的累積,通過 MRI 引導遞送進行介導定位和監測。因此,奈米載體可以在 NP 在腫瘤中積累後增強癌細胞中對於順鉑化療藥的累積並激活 NOX,從而引發連鎖反應形成 H2O2。鐵奈米顆粒在癌細胞中降解並代謝,釋放出過量的不穩定鐵離子,催化 H2O2 分解 在癌細胞內為劇毒的 ROS;這會導致細胞膜的快速氧化和退化。豐富的 ROS 與順鉑協同作用,並在體內顯示出增強的抗腫瘤功效。對於降低癌細胞的抗藥性與降低副作用的優異特性,使這種新的遞送方法成為具有臨床重要、且有發展前景前途的抗癌策略。
期刊原文:
Enhanced Cisplatin Chemotherapy by Iron Oxide Nanocarrier-Mediated Generation of Highly Toxic Reactive Oxygen Species. (Nano Letters. 2017, 17, 928−937)
https://pubs.acs.org/doi/10.1021/acs.nanolett.6b04269

