腦腸軸、腸腦軸是一種複雜的雙向機制,將大腦的認知中樞與腸道周邊神經聯繫在一起,常被探討的層面包含: 腸道免疫、腸道通透性、腸道反射和內分泌訊號傳導。近年來,腸道微生物基因研究為人類帶來了新的跨學科視角,致使科學家開始探討如何利用腸腦軸來治療胃腸道和精神疾病。包含益生菌、益生元和糞便移植,逐漸被開發為輔助療法或主要療法,並取得了正向的結果。在膳食補充劑中,除了益生菌、益生元以外,維生素和礦物質也被證明對腸腦軸的平衡有益。礦物質中的鎂具有神經保護的效用,因此本篇的探討重點,將關注鎂對於腸道菌的影響,以及調控腸腦軸的可能作用機轉。
腸道微生物代謝產物影響鎂吸收
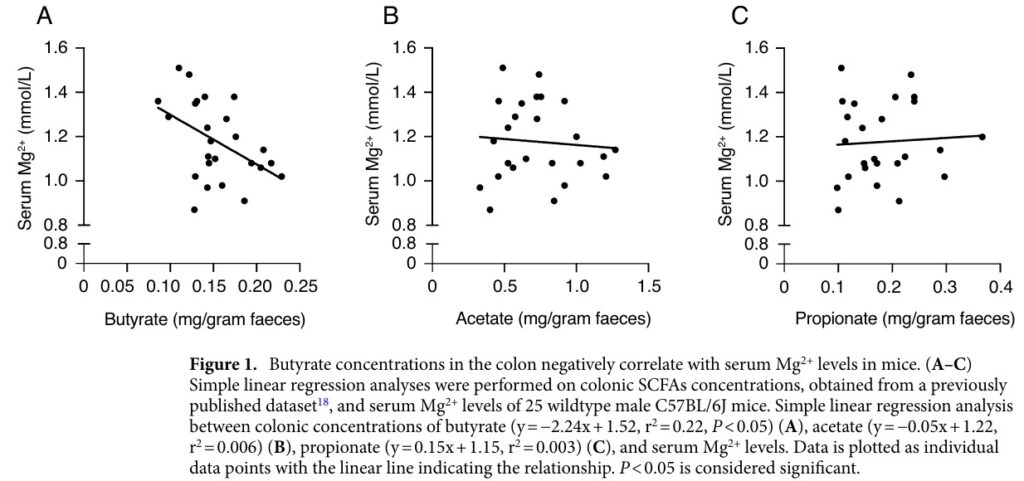
膳食纖維在結腸內被腸道微生物消化,轉為短鏈脂肪酸(Short-chain Fatty acids, SCFAs),主要型式包含乙酸、丙酸、丁酸,合計占了SCFA的83%。SCFAs會快速被胃腸道的上皮細胞吸收,是腸道細胞的主要能量來源,其濃度決定二價陽離子的吸收效率。常見的益生菌如乳酸桿菌與雙歧桿菌,可透過上述方式,協助亞鐵離子與鈣離子的吸收。下圖來自2022年的期刊1,利用小鼠試驗,分析糞便中鎂離子的含量,探討SCFAs濃度對於鎂離子吸收的影響。結果顯示,丁酸(butyrate)可負向調控鎂離子的攝取,但乙酸(acetate)與丙酸(propionate)則不產生影響。
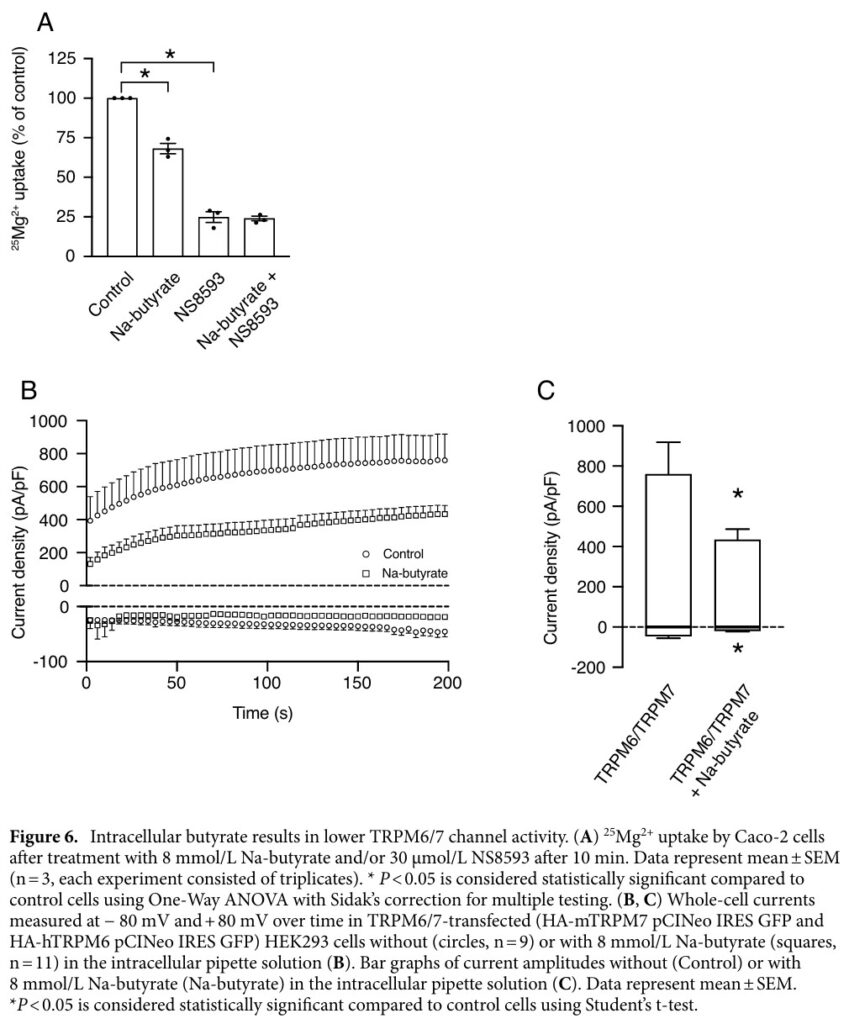
來自同論文的另一張圖,則是以CACO2大腸細胞株進行試驗,探討丁酸抑制鎂離子吸收的作用機轉。透過電生理檢查,證實細胞內丁酸鹽直接降低了(TRPM)6/7離子通道的活性,干擾鎂離子吸收。本研究除確定丁酸是腸道鎂離子的新型調節劑,也進一步確認了微生物代謝產物對於細胞吸收礦物質的調節作用,可正向亦可負向。
補充鎂改善腸躁症之腸道菌相
除了腸道微生物可調控鎂的吸收,發炎性腸道疾病inflammatory bowel disease (IBD)也會造成營養吸收不良,導致鎂的缺乏。在IBD患者中,鎂缺乏與疾病嚴重程度相關。下圖來自2021年的期刊2,應用DSS誘導的IBD小鼠模型,評估鎂對於腸道菌相的影響。以16S-rRNA分析糞便樣本中腸道微生物群的豐富度,缺乏鎂的小鼠表現出較低的放線菌(actinobacteria)豐富度和較高的擬桿菌(bacteroidetes)豐富度;補充鎂之後,則使變形菌(proteobacteria)減少和TM7增加。
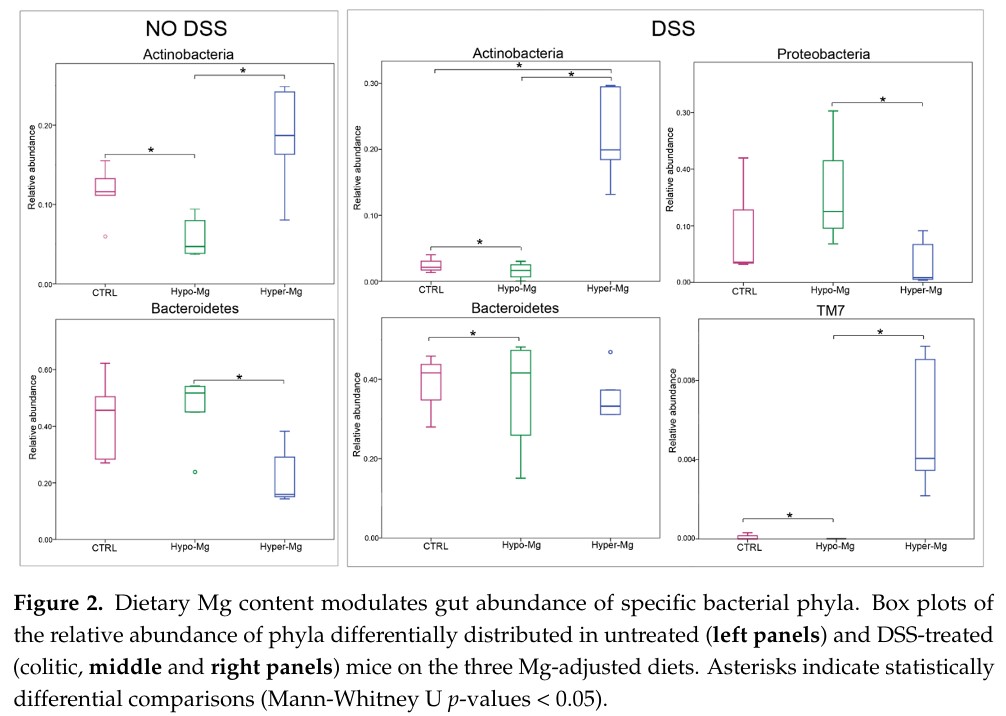
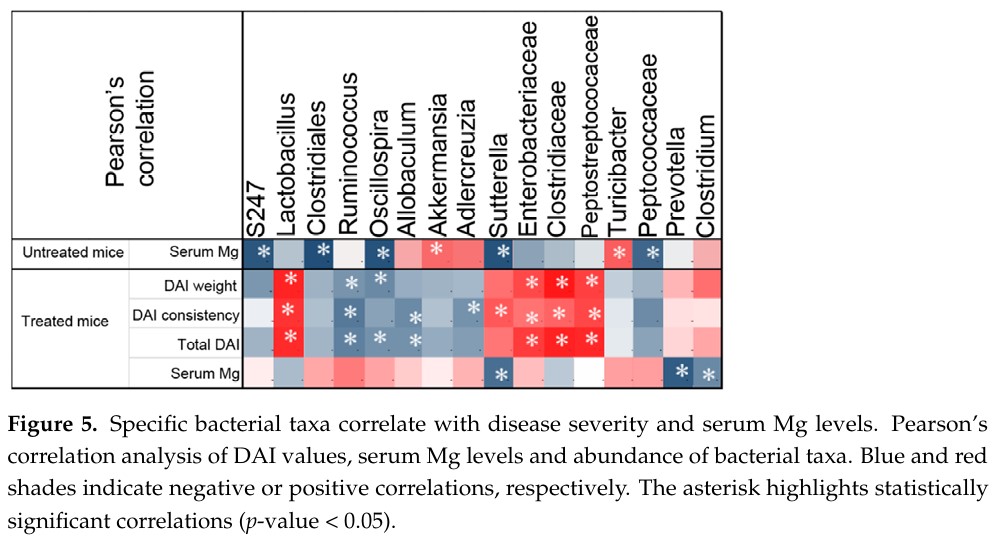
來自同論文的另一張圖,作者對disease activity index (DAI)值、血清鎂和微生物豐富度進行了Pearson相關分析。血清鎂的分析,顯示其濃度與疾病嚴重程度呈負相關。微生物豐富度分析,顯示鎂與Akkermansia和Turicibacter呈正相關;對S247、Clostridium、Sutterella等菌科呈負相關。上述研究結果表明,補充鎂可能是一種安全且便宜的方法去改善IBD與腸道菌相。
補充鎂改善腸道菌相與情緒
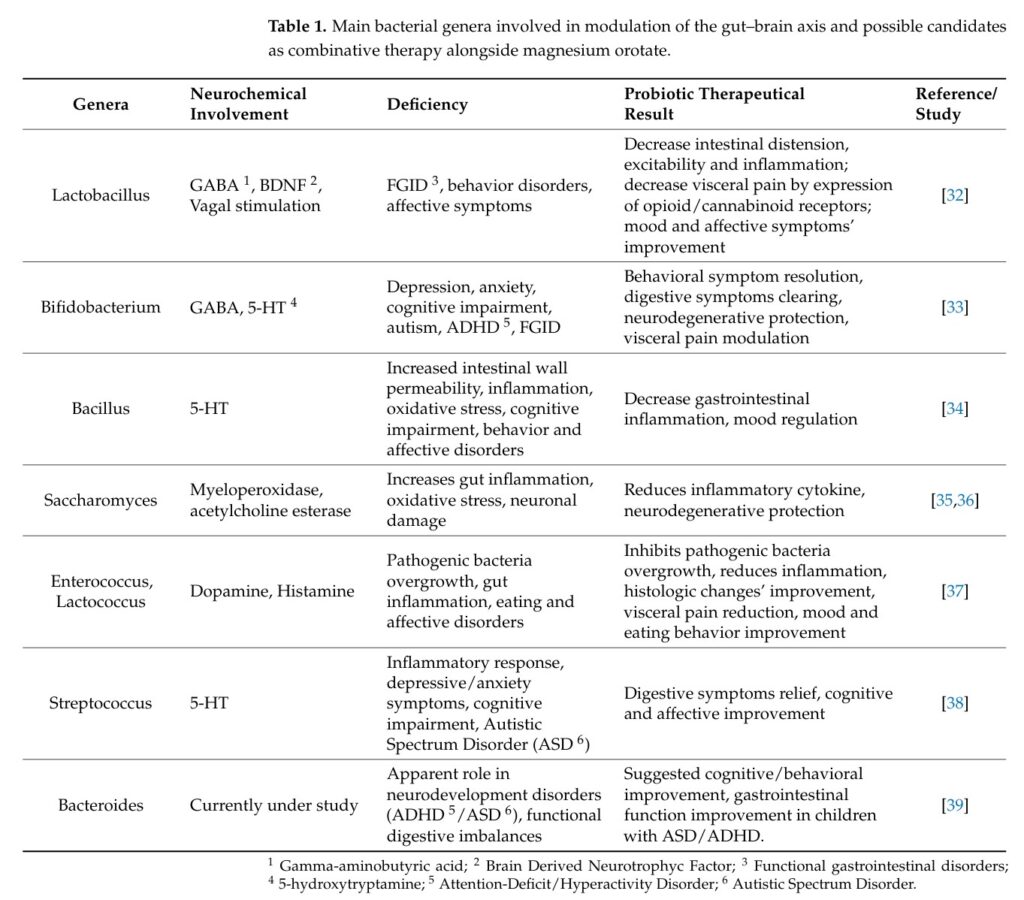
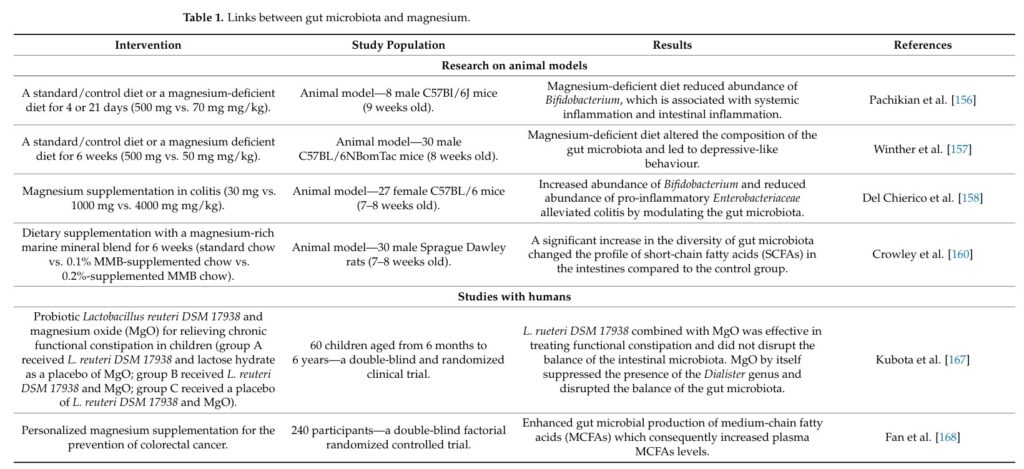
表觀遺傳學,指的是不改變生物體的基本DNA序列,僅做細胞表型之修飾。飲食中的營養素可透過表觀遺傳修飾,影響腸道微生物。除了常被研究的SCFAs之外,維生素與礦物質亦有可能透過表觀遺傳學,影響腸道微生物與生物體的情緒,但仍需要更多的科學證據支持。下表來自2024年的期刊3,列舉了數個與鎂相關的動物或人體試驗。在這些案例中,若飲食或飼料缺乏鎂,可導致腸道發炎,減少腸道益菌如雙歧桿菌,並讓個體產生憂鬱行為;補充鎂之後,則可改善發炎反應,增加SCFAs,恢復雙歧桿菌含量,並降低促發炎的腸桿菌含量。
鎂影響腸腦軸的可能機轉
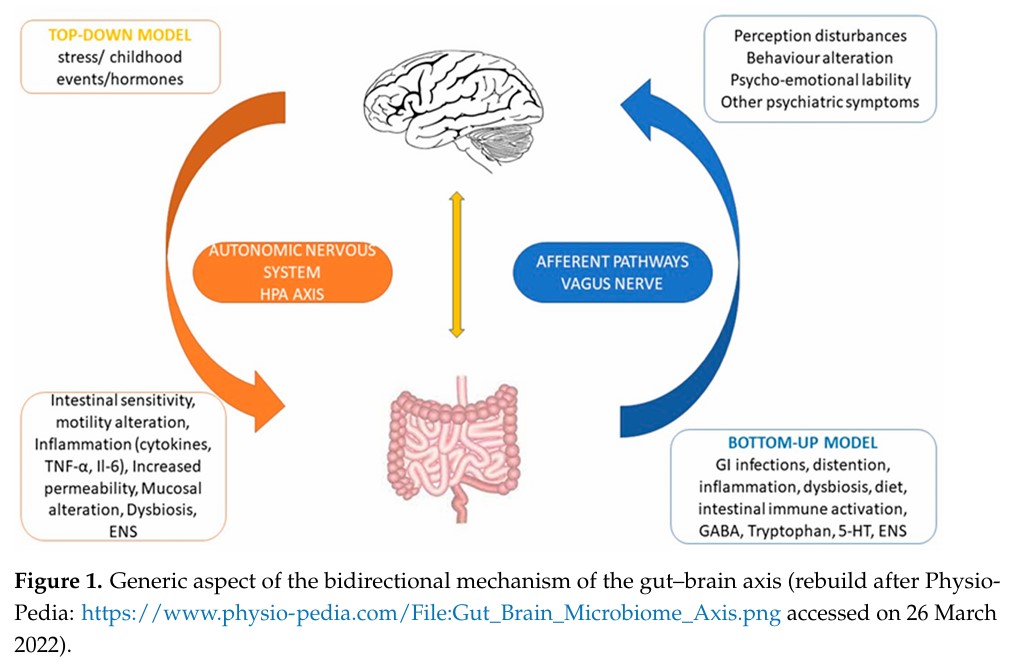
腸腦軸是從腸道環境到大腦的通訊路徑,即透過腸內神經傳導物質的產生和表達,影響腦源性神經營養因子。當腸壁的完整性不夠緊密,或由腸道菌相失衡而誘發的發炎反應,都會破獲腸腦軸的正常運作。舉例而言,腸道產生的促發炎因子TNF-a,已被證明與焦慮、憂鬱症狀的嚴重程度成正相關。
下表來自2022年的期刊4,目的為探討鎂調控腸腦軸的可能機轉。常見的益生菌中,與乳酸桿菌相關的神經傳導物質為GABA、BDNF;與雙歧桿菌相關的神經傳導物質為GABA、5-HT。當鎂攝取不足,將造成雙歧桿菌含量下降,間接導致 GABA、5-HT 前驅物的分泌功能失調,產生的精神症狀包含: 憂鬱、焦慮、認知功能受損、自閉症、專注力不足過動症等。
總結:
下圖來自同篇論文,恰可作為本文的總結。此圖描述腦腸軸、腸腦軸之間的雙向連結,是一個複雜的平衡。中樞神經系統和腸神經系統,透過交感神經和副交感神經軸進行協調,神經傳導物質則是串連下視丘-腦下垂體-腎上腺軸的信息分子。
從飲食補充鎂有助於維持腸道菌相的平衡,透過表觀遺傳學的機制,則促使腸道益菌發揮作用,釋出相對應的神經傳導物質,確保情緒和高階認知功能的完整。近年亦發現腸道微生物的代謝產物丁酸,可以關閉腸細胞的鎂離子通道,阻止鎂離子的攝取,這很可能是一種負回饋機制,也代表鎂很可能是演化所產生,專門用來調控腸道微生物的關鍵因子。在未來,針對腸腦軸設計高生物利用度和高效的鎂形式,或許將成為開發精神疾病治療方法的新穎策略。
參考文獻:
- Lisanne M. M. Gommers, Pieter A. Leermakers, Jenny van der Wijst, Sara R. Roig, Anastasia Adella, Melissa A. E. van de Wal, René J. M. Bindels, Jeroen H. F. de Baaij & Joost G. J. Hoenderop. Butyrate reduces cellular magnesium absorption independently of metabolic regulation in Caco‑2 human colon cells. Scientific Reports | (2022) 12:18551.
- Del Chierico, F.; Trapani, V.; Petito, V.; Reddel, S.; Pietropaolo, G.; Graziani, C.; Masi, L.; Gasbarrini, A.; Putignani, L.; Scaldaferri, F.; et al. Dietary Magnesium Alleviates Experimental Murine Colitis through Modulation of Gut Microbiota. Nutrients 2021, 13, 4188.https:// doi.org//10.3390/nu13124188
- Ferenc, K.; Sokal Dembowska, A.; Helma, K.; Motyka, E.; Jarmakiewicz-Czaja, S.; Filip, R. Modulation of the Gut Microbiota by Nutrition and Its Relationship to Epigenetics. Int. J. Mol. Sci. 2024, 25, 1228.https://doi.org/10.3390/ ijms25021228
- Schiopu, C.; S ,tef˘ anescu, G.; Diaconescu, S.; B˘ alan, G.G.; Gimiga, N.; Rusu, E.; Moldovan, C.A.; Popa, B.; Tataranu, E.; Olteanu, A.V.; et al. Magnesium Orotate and the Microbiome–Gut–Brain Axis Modulation: New Approaches in Psychological Comorbidities of Gastrointestinal Functional Disorders. Nutrients 2022, 14, 1567.https:// doi.org/10.3390/nu14081567